(1)胆管形成
肝臓・胆道系の初期発生については、近年遺伝子改変動物を用いた研究が盛んに行われ、その発生機序の詳細が明らかになりつつある。マウス胚の場合、E8.25(3〜4 Somite stage)に将来心臓となる中胚葉組織から分泌されるFibroblast growth factor (FGF)により前腸腹壁内胚葉に肝臓予定領域が誘導され、肝臓原基となる。肝臓原基の内胚葉上皮細胞は増殖し、E8.5~9.0には肝芽(Hepatic bud)を形成する。肝芽は憩室様の構造を呈し、肝憩室(Hepatic diverticulum)と呼ばれる。肝芽と心臓原基の間に間葉組織(間充織)の横中隔(Septum transversum)が発達し、Bone morphogenetic protein (BMP)を分泌する。肝憩室は頭部・尾部の2部に分かれ、頭部肝憩室を構成する内胚葉細胞が隣接する間充織には臍腸間静脈が通っており、肝芽の上皮直下の間充織には毛細血管が出現し、その内皮細胞が肝芽細胞(Hepatoblasts)を横中隔内部へと誘導し肝組織が形成される(E9.0~9.5)。その後造血幹細胞が移入し、造血器官となるため胎仔肝臓の組織構築は非常に複雑なものとなる。一方、肝外胆管[Cystic duct, Hepatic duct, Common bile ductおよびGallbladder(胆嚢)]は肝憩室尾部から発生する。肝芽細胞はHhex/Prox1を発現し、血管内皮細胞の分泌するHepatocyte growth factor (HGF)、線維芽細胞が分泌するFGF10, 中皮細胞の分泌するPleiotrophin/midkineにより増殖し間充織中に浸入する。肝芽細胞は造血幹細胞の分泌するOncostatin M (OSM)により肝細胞に分化する。この時期、肝臓には肝内胆管は発生していない(図1)。
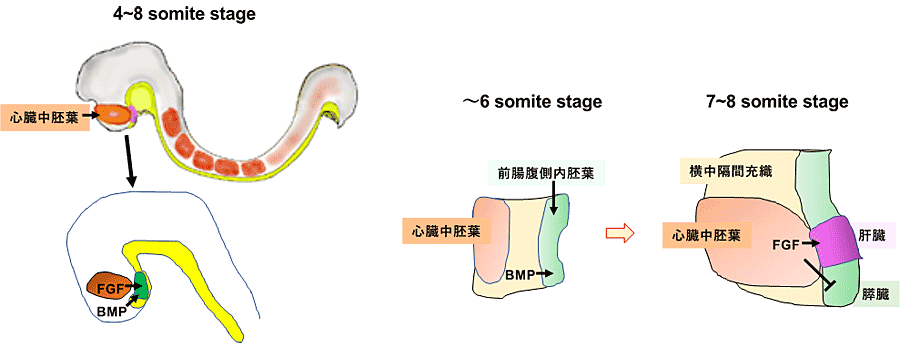 図1. マウス肝臓初期発生と胆管分化
図1. マウス肝臓初期発生と胆管分化
胆管は、肝臓内の肝内胆管と肝臓外の肝外胆管が肝門部で接続する。肝外胆管は、E9.5の時点で既に肝臓本体を形成する部分とは別に発生が進む。肝内胆管を構成する胆管上皮細胞は、E8頃に前腸腹側内胚葉に認められるHex(+)Sox17(-)Pdx1(-)細胞由来の肝芽細胞から胎生中期に分化する。一方、肝外胆管は、腹側膵臓と共にHex(-)Sox17(+)Pdx1(+)細胞から発生する(図2)。
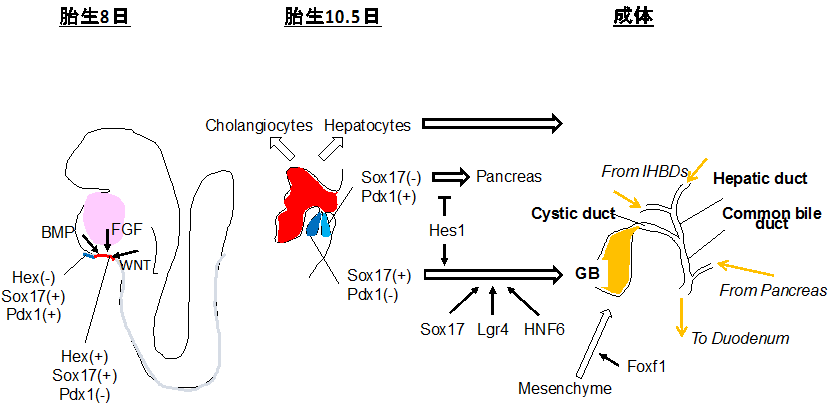 図2. 前腸内胚葉(foregut endoderm)からの肝内及び肝外胆管の発生
図2. 前腸内胚葉(foregut endoderm)からの肝内及び肝外胆管の発生
マウスでは、E13.5に門脈周囲の肝芽細胞が胆管上皮細胞へと運命決定されることによって肝内胆管の発生が始まる。門脈近傍の肝芽細胞では、Jagged-1陽性の線維芽細胞との接触により肝芽細胞のNotchシグナルが活性化される。更に血管内皮細胞及び線維芽細胞が分泌するTGFβの刺激を受けて胆管上皮細胞へと分化する。その後、胆管上皮細胞がJagged-1を発現して隣接する肝芽細胞のNotchシグナルを活性化する、というように段階的にシグナル活性化が起こり、胆管上皮細胞の分化が進む(図3)。
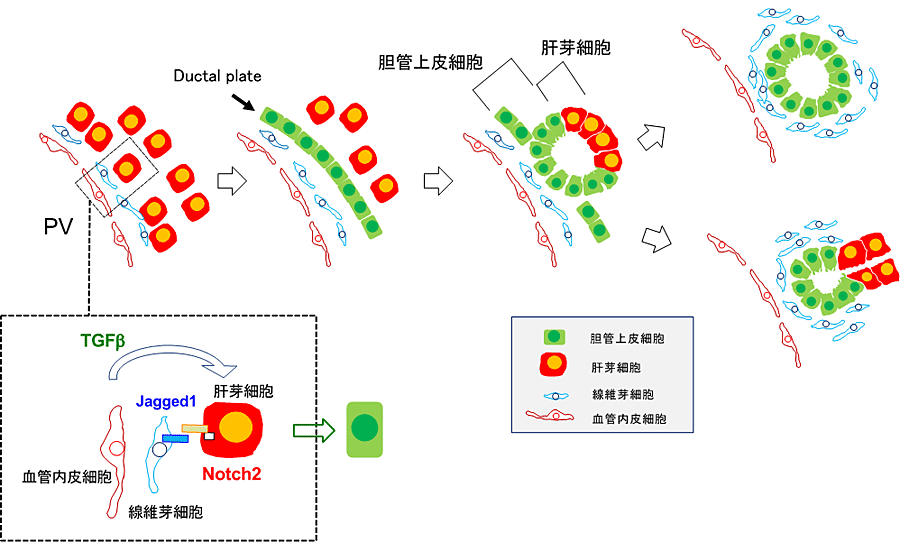 図3. 肝芽細胞から胆管上皮細胞への分化と胆管の形態形成
図3. 肝芽細胞から胆管上皮細胞への分化と胆管の形態形成
胎仔期の胆管形成過程では、非対称な構造(asymmetric ducts)を持つ胆管が認められる。管腔構造の門脈側にはCytokeratin(+)Sox9(+)HNF4α(-)でラミニンを含む基底膜に支持された胆管上皮細胞が存在し、その対面にはCytokeratin(-)Sox9(-)HNF4α(+)の肝芽細胞が存在している。E13.5-E14.5に門脈周囲に形成された非対称的な2層構造を持つ胆管中の肝芽細胞は成熟した胆管上皮細胞に分化し、対称的な構造を持つ成熟した胆管(symmetric ducts)になる。胎仔期の未熟な胆管構造をラベルし、その後の運命をたどると、①胆管、②ヘリング管、③門脈周囲の肝細胞、の3種類の細胞へと分化することがわかっている。
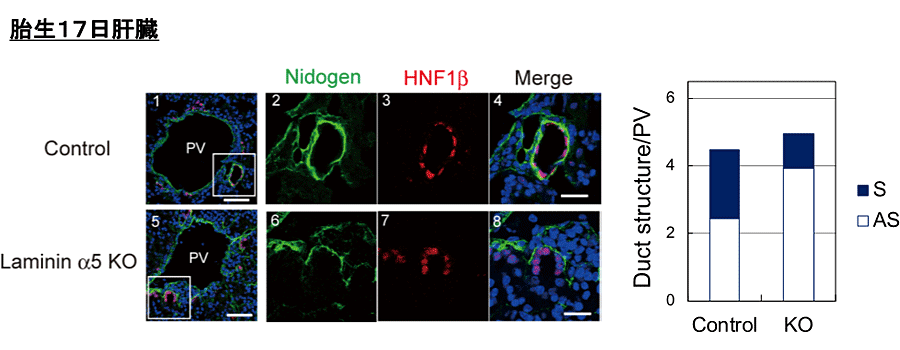 図4. Laminin α5のノックアウトによる胆管形成の遅延
図4. Laminin α5のノックアウトによる胆管形成の遅延
Nidogen (基底膜の構成タンパク質)とHNF1β(胆管上皮細胞のマーカー)に対する抗体による染色像。ノックアウトの肝臓では、lumenの一部が胆管上皮細胞に囲まれた“非対称な構造(asymmetric)”の割合が多くなっていることから、胆管の形成が遅延していると考えられる。
胆管形成のメカズムは、In vitroの3次元培養を用いた解析をおこなうことができる(1)。肝芽細胞から樹立したHPPL(2)は、Laminin 111を含むゲル中で3次元的に培養すると、胆管上皮細胞と同様の細胞極性を獲得し、中央に管腔構造を伴ったCystを形成する(3)。Cystを形成するHPPLは、胆管上皮細胞マーカーを発現し、管腔内への分泌能など胆管上皮細胞としての性質を備えており、Laminin111が極性形成・管腔形成に必須である。一方、HPPLはLaminin521を発現しており、管腔を形成したCystはLaminin521を含む細胞外マトリックスの層に囲まれている。Laminin α5のKnockout miceの肝臓では、残存するα1鎖を含むLaminin111の存在によって胆管上皮細胞の分化などに異常はないが、胆管構造形成の遅延が見られる(図4)(4)。
HPPLが形成するCyst構造は成体由来の胆管上皮細胞が形成するものと比較すると管腔が小さく未熟である。肝芽細胞と胆管上皮細胞の比較を行うと、胆管上皮細胞特異的な遺伝子を同定することができる。管腔サイズを決定する因子を同定したところGrainyhead-like 2 (Grhl2)が管腔を大きく発達させ、細胞間バリア機能を亢進させることが分かった(図5)(5)。Rab25がClaudin4のタイト結合への局在を促進し、バリア機能を亢進させていると考えられる。
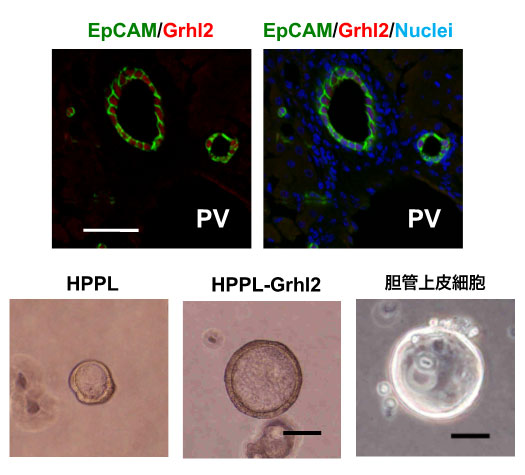 図5. 転写因子Grhl2の導入による管腔構造の発達
図5. 転写因子Grhl2の導入による管腔構造の発達
Grhl2は、管状構造を形成する胆管上皮細胞に特異的に発現している。HPPLにGrhl2を導入すると、管腔が大きく発達する。成体肝臓からEpCAM陽性細胞として分離した胆管上皮細胞も、3次元培養において管腔構造が発達したCystを形成する。Scale bars; 50 μm
胆管は、樹枝状の構造を肝組織内に張り巡らせている。これまでは切片を用いた解析であったので、3次元的な構造を詳細に解析することが難しかった。は、肝門部から抹消に向かって樹枝状に発達する。我々は、透明化した肝臓に肝外胆管からインクを注入し、肝内胆管の形成過程を可視化することにより詳細に検討した(図6)(6)。
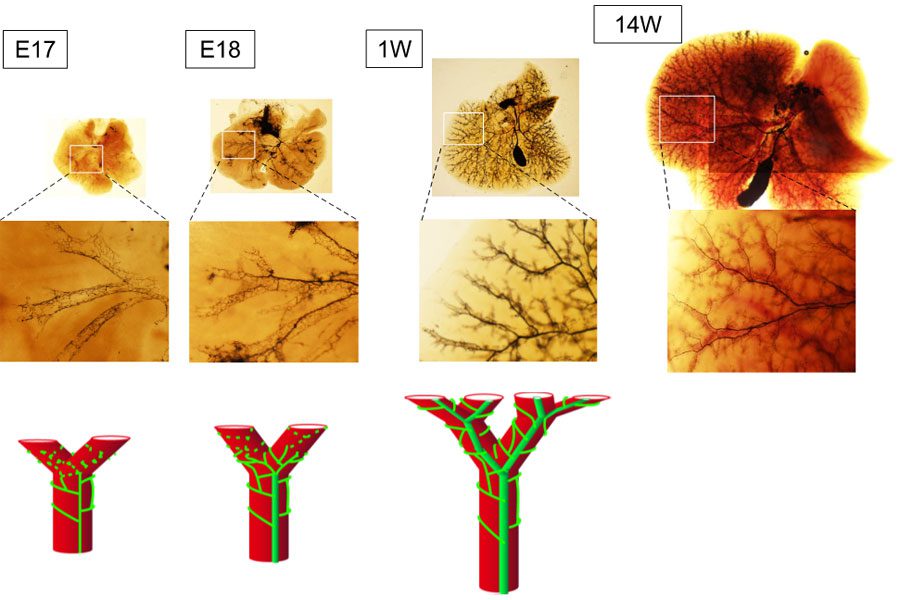 図6. 胆管の管腔3次元ネットワーク構造の形成
図6. 胆管の管腔3次元ネットワーク構造の形成
成熟した肝内胆管は、太い細胆管と細い網目状構造を呈する小葉間胆管からなる階層構造(hierarchical luminal network)を呈する。太い細胆管は門脈に沿って発達し、細い小葉間胆管は門脈を網目状に取り囲むように発達している。肝臓末梢部においては出生後も細い網目状構造のみからなる未熟な構造が認められるが、生後1週目までにはHierarchical luminal networkは完成する。
胎生期における胆管発生を調べると、体制7日目(E17) までに、管腔が連続した胆管構造が形成されていた。E17からE18の間に、管腔サイズが小さく均一な管腔ネットワークから、小葉間胆管と細胆管から構成される階層性を持つ管腔ネットワークに変化する。そして肝細胞の毛細胆管構造は、胎生後期に急速に発達する(図7)。またE17からE18にかけて、肝芽細胞におけるビリルビンのグルクロン酸抱合酵素UDP-glucuronyl transferase (UDPGT)の発現が増加する。
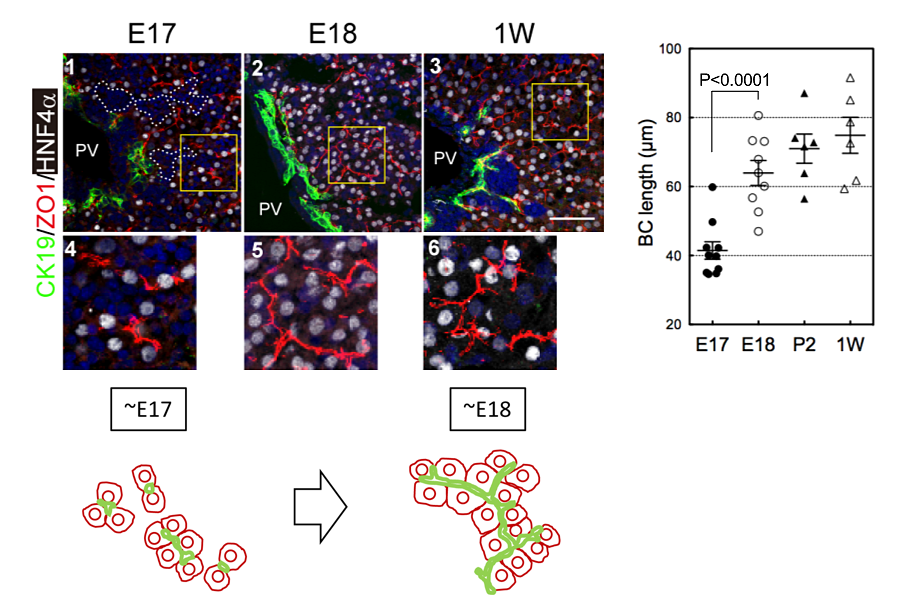 図7. マウス肝臓発生過程における毛細胆管長の変化
図7. マウス肝臓発生過程における毛細胆管長の変化
毛細胆管網が形成されるE16からE18にかけて、ビリルビンの毛細胆管への排泄を担うトランスポーター(MRP2)阻害剤であるBenzbromaroneを投与して毛細胆管網の形成を阻害すると、胆管のリモデリングが阻害された(図8)。この結果は、毛細胆管から流れ込む胆汁流量の変化が、胆管のリモデリングを促していることを示唆する。
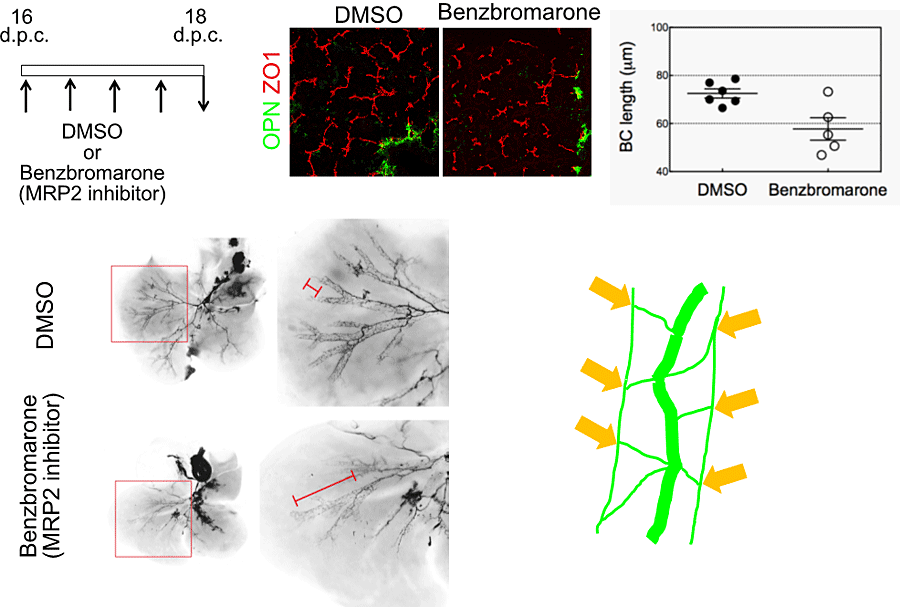 図8. Multidrug resistance-related protein 2(MRP2)阻害剤による毛細胆管形成の阻害
図8. Multidrug resistance-related protein 2(MRP2)阻害剤による毛細胆管形成の阻害
Jagged1, RBPJκ, Notch2遺伝子のconditional knockout miceを用いた研究から、発生後期の管腔構造形成にもNotchシグナルが重要な働きをしていることが分かっている。我々は、生後2~6日の間にγ-secretase阻害剤であるDAPTを腹腔注射すると、肝内胆管の管腔構造形成が抑制されることを見いだした(6)。胆管上皮細胞の上皮細胞極性に異常はみられないが、末梢部では胆管上皮細胞の数が少なく、断裂した小胆管が繋がらずに残っている。この結果は、Notchシグナルが肝内胆管網形成に必要な胆管上皮細胞の供給に重要な役割を果たしていることを示唆している。
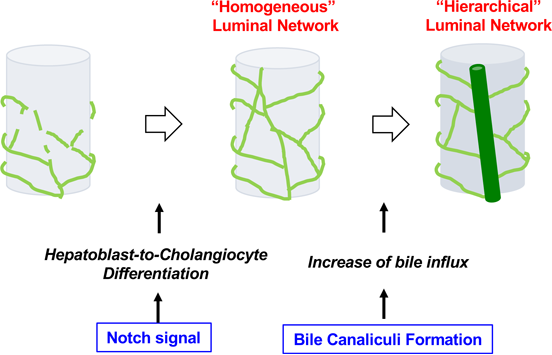 図9. マウス肝発生における肝内胆管の形成過程
図9. マウス肝発生における肝内胆管の形成過程
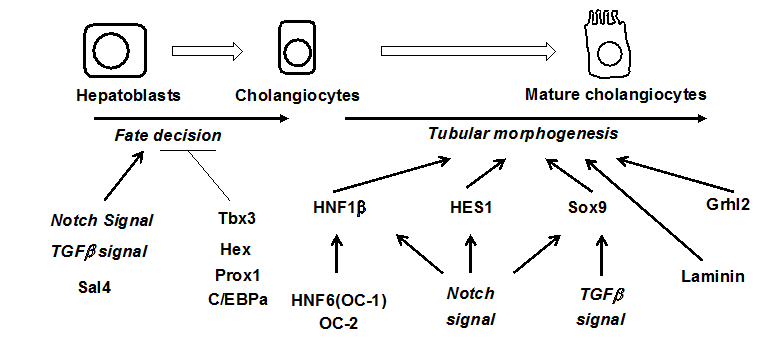 図10. 肝内胆管形成に関与する遺伝子とシグナル
図10. 肝内胆管形成に関与する遺伝子とシグナル
胆管発生に関与する遺伝子及びシグナルについて図10に示した。
- 谷水直樹.肝発生過程における胆管上皮細胞の分化能の変化.肝細胞研究会ホームページ ─ 研究交流
- Tanimizu N, Mitaka T. Morphogenesis of Liver Epithelial Cells. Hepatol Res, 46(10): 964-976 (2016)
- Tanimizu N, Mitaka T. Epithelial morphogenesis during liver development. Cold Spring Harb Perspect Biol, Feb 17; pil: a027862 (2017)
- Tanimizu N, et al. Liver progenitor cells fold up a cell monolayer into a double-layered structure during tubular morphogenesis. Mol Biol Cell 20, 2486-2494 (2009)
- Tanimizu N, et al. Long-term culture of hepatic progenitors derived from mouse Dlk+ hepatoblasts. J Cell Sci. 117, 6425-6434 (2004)
- Tanimizu N, et al. Liver progenitor cells develop cholangiocyte-type epithelial polarity in three dimensional culture. Mol Biol Cell 18, 1472-1479 (2007)
- Tanimizu N, et al. α1- and α5-containing laminins regulate the development of bile ducts via β1-intergrin signals. J Biol Chem, Aug17; 287(34): 28586-28597 (2012)
- Senga K, Tanimizu N, et al. Grhl2 regulates epithelial morphogenesis by establishing functional tight junctions through the organization of a molecular network among claudin3, claudin4, and Rab25. Mol Biol Cell, 23(15): 2845-2855 (2012)
- Tanimizu N, et al. Intrahepatic bile ducts are developed through formation of homogeneous continuous luminal network and its dynamic rearrangement. Hepatology, 64(1):175-188 (2016)



