肝上皮細胞の分化可塑性
肝臓を構成する上皮細胞である肝細胞と胆管上皮細胞は、胎生中期に肝芽細胞(胎仔の肝幹細胞)から分化する。成熟した肝臓の健常時の細胞のターンオーバーや、一過性の肝組織障害後には、肝細胞あるいは胆管上皮細胞がそれぞれ増殖することで肝組織が維持・再生される。これに対して、肝組織が慢性的な障害に晒された場合には、肝幹・前駆細胞が活性化し、肝細胞あるいは胆管上皮細胞に分化すると考えられてきた。さらに、成熟分化した肝上皮細胞も分化可塑性を有しており、肝細胞の脱分化や肝細胞から胆管上皮細胞あるいは胆管上皮細胞から肝細胞への分化転換などが肝再生に寄与している可能性も示されている。しかしながら、肝幹・前駆細胞の活性化、肝細胞あるいは胆管上皮細胞の分化可塑性がどのように制御されているかについては不明な点が残されている。また、分化可塑性や増殖能の観点から、肝細胞と胆管上皮細胞がHeterogeneousな細胞集団であることも指摘されている。我々は、肝上皮細胞の供給様式を明らかにするために、発生過程における胆管上皮細胞の分化可塑性の変化や、肝細胞の脱分化についての解析を行ってきた(総説参照)。
1. 胆管上皮細胞の分化可塑性
発生過程における胆管上皮細胞の肝細胞分化能の変化
我々は、新生仔期(生後1週目)および成体(生後6~8週目)のマウス肝臓からEpCAM(+)の胆管上皮細胞を分離し、増殖および分化能の変化を解析した(1)。生後1週目の肝臓から分離したEpCAM(+)細胞は、アルブミン(ALB)陽性の肝細胞とサイトケラチン19 (CK19)陽性の胆管上皮細胞から構成されるコロニーと、CK19(+)細胞のみから構成されるコロニーを形成した。発生が進行するに従って、コロニー数の低下とともに、ALB(+)CK19(+)コロニーの割合は減少した (図1)。次に、EpCAM(+)細胞に対してオンコスタチンMの添加とマトリゲルの重層を行って肝細胞への分化成熟を誘導した。新生仔期のEpCAM陽性の胆管上皮細胞は、代謝酵素やCytochrome P450 (Cyp) のmRNAを発現するようになり、アンモニア代謝能を獲得し、毛細胆管様構造を形成するなど、成熟肝細胞様の細胞に分化した。一方、成体の胆管上皮細胞の培養では、遺伝子レベルでわずかにアルブミンの発現が上昇したものの、代謝酵素の発現は誘導されなかった。さらに、Retrorsine投与によって肝細胞増殖を抑制した免疫不全マウスに、部分肝切除とともに細胞移植を行ったところ、新生仔のEpCAM(+)細胞は肝細胞および胆管様細胞として生着した(図2)。以上の結果から、胆管上皮細胞は、新生仔期には肝細胞への分化能を持つが、成体に至るとその能力を失うと考えられた(1,2)。
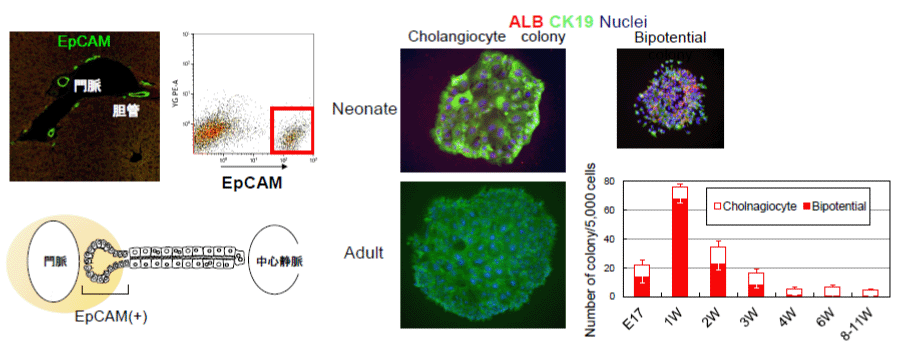
図1. 発生過程における胆管上皮細胞の性状変化
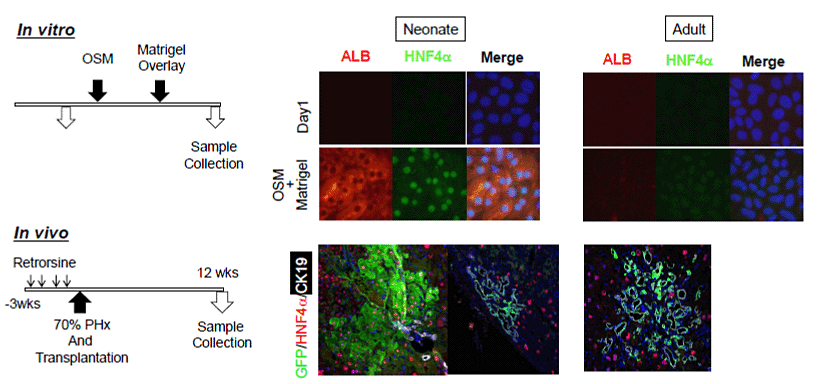
図2. In vitro 及びIn vivoにおける胆管上皮細胞から肝細胞への分化
胆管上皮細胞の分化能を制御する分子メカニズム
肝芽細胞の分化過程では、NotchシグナルによってHNF4α,C/EBPα,HNF1βなどの転写因子発現が調節され、肝細胞あるいは胆管上皮細胞への運命が決定する。胆管上皮細胞の分化誘導過程においても転写因子発現の変化が重要である。OSMとMatrigelの添加によって肝細胞への分化を誘導すると、新生仔の細胞ではHNF4αやC/EBPαの発現が誘導されるのに対して、成体の細胞では、これらの転写因子は誘導されなかった。しかしながら、成体の胆管上皮細胞にHNF4αやC/EBPαを導入しても、アルブミンやカルバモイルリン酸合成酵素(CPSI)の遺伝子発現がわずかに誘導されただけで、肝細胞への分化・成熟は誘導できなかった(2)。
そこで、成体の胆管上皮細胞には肝細胞への分化を抑制する機構が存在しているのではないかと考えた。新生仔と成体の胆管上皮細胞を比較すると、胆管上皮細胞時的な転写因子の発現に差があることが明らかになった。それらの中で、我々が胆管上皮細胞の密着結合の形成を促進する因子として同定した転写因子Grainyhead-like 2 (Grhl2)の発現レベルも、新生仔で成体よりも低いことがわかった。Grhl2の強制発現は、HNF4αおよびC/EBPαの発現誘導を抑制し、新生仔胆管上皮細胞の肝細胞分化を抑制した(3)。さらに、Grhl2は様々な肝細胞機能に関与しているmiR122の発現を転写レベルで抑制していることも明らかになった(1)。以上の結果から、胆管上皮細胞では、発生の過程でGrhl2の発現が増強することで、上皮細胞として成熟化が促され、肝細胞への分化能が制限されると考えられる(図3)。
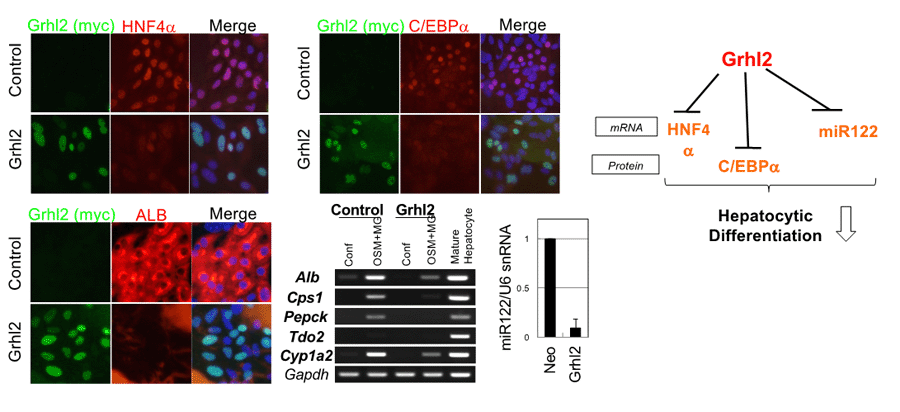 図3. Grhl2による肝細胞分化の阻害
図3. Grhl2による肝細胞分化の阻害
肝細胞の分化可塑性
マウスにDDC-dietを与えたり、胆管結紮を行って慢性肝障害を負荷すると、胆管が増生する(偽胆管反応)。我々は、胆管増生に加えて、胆管上皮細胞特異的な転写因子であるSOX9を発現する肝細胞が出現することを見いだした。Mx1Cre:ROSAマウスにPoly(IC)を投与して成熟肝細胞をLacZ発現によってラベルした後に、肝障害を負荷したところ、LacZ(+)SOX9(+)肝細胞が出現した(図4)。以上のことから、慢性肝障害時には、一部の成熟肝細胞が脱分化することによりSOX9(+)肝細胞が出現することが明らかになった(4)。
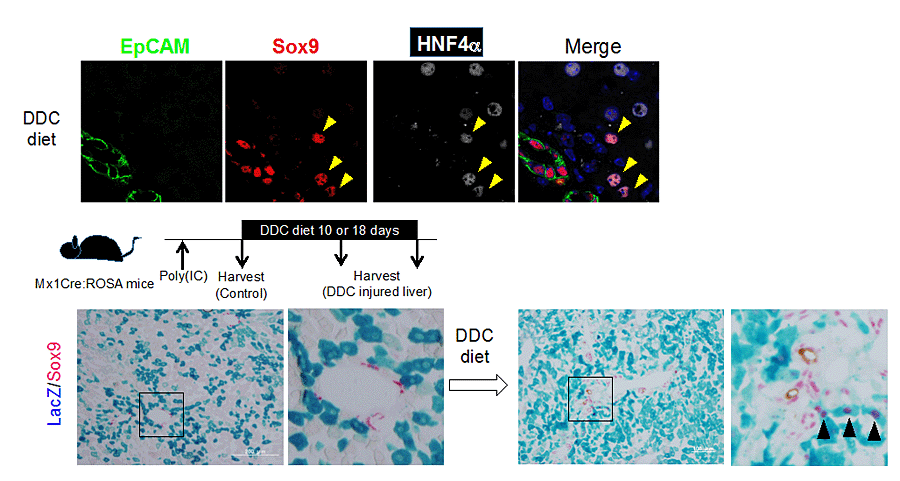 図4. 肝細胞の脱分化とSOX9(+)肝細胞の出現
図4. 肝細胞の脱分化とSOX9(+)肝細胞の出現
SOX9(+)肝細胞の性状を明らかにするために、SOX9-EGFP マウスにDDC-dietを与えて肝細胞脱分化を誘導し、GFP(+)EpCAM(-)肝細胞を分離した。Microarrayを用いて成熟肝細胞とSOX9(+)肝細胞の遺伝子発現プロファイルの比較を行ったところ、肝機能を担う代謝酵素や、薬剤代謝酵素であるチトクロームP450 (Cyp)の発現が低いことが明らかになった。SOX9(+)肝細胞は増殖能が高く、成熟肝細胞に再分化する能力を持った細胞であった(図5)。一方で、3次元培養を行っても胆管上皮細胞への分化指標となるシスト構造を形成することはなかった。
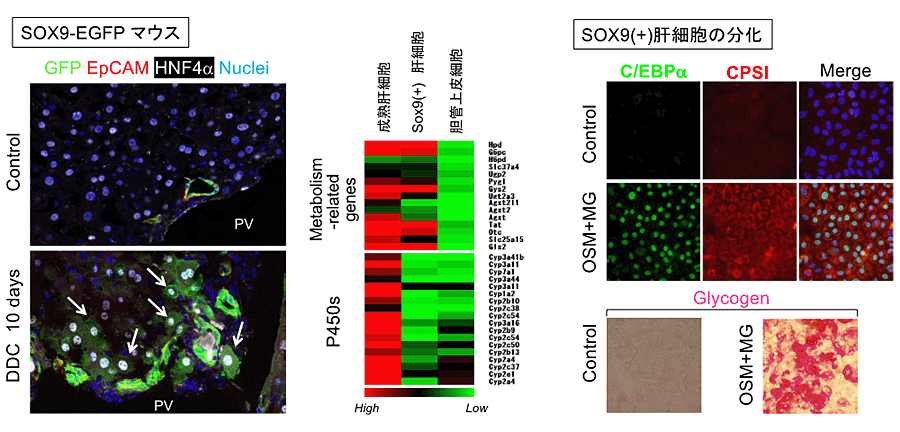 図5. SOX9(+)肝細胞のin vitroでの分化
図5. SOX9(+)肝細胞のin vitroでの分化
また、SOX9(+)肝細胞はCD24(-)とCD24(+)からなるHeterogeneousな細胞集団であり、増殖性の肝前駆細胞はCD24(+)画分に濃縮されていた。さらに、CD24(+)のSOX9(+)肝細胞をRetrorsine投与後に部分肝切除を行ったマウスに移植すると、肝細胞として生着することも明らかになった(図6)。以上のことから、肝臓が慢性的に障害されると一部の肝細胞が脱分化することが明らかになり、脱分化した肝細胞は増殖し、成熟肝細胞に再分化することで肝再生に寄与している可能性が考えられる(5)。
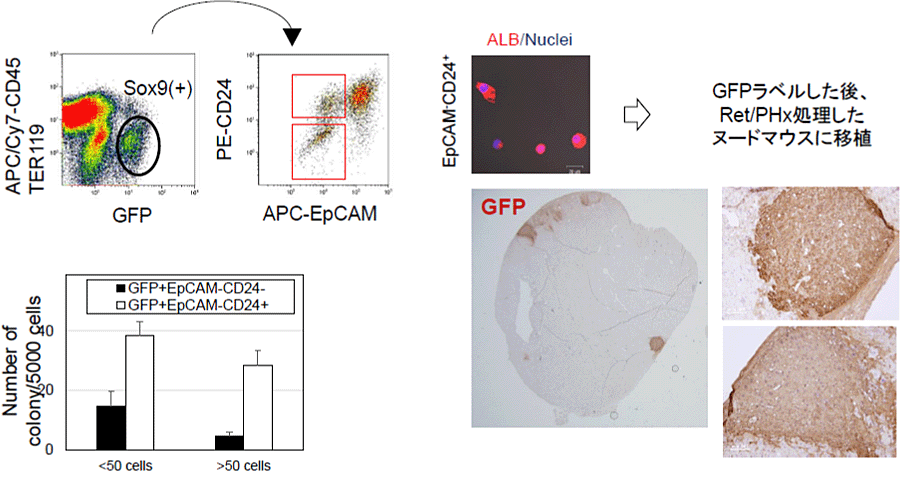 図6. SOX9(+)CD24(+)肝細胞の肝前駆細胞としての性質
図6. SOX9(+)CD24(+)肝細胞の肝前駆細胞としての性質
我々の解析結果は、肝細胞の方が柔軟にその性質を変化させる能力があることを示唆している。胆管形成不全のマウスで肝細胞から胆管上皮細胞が分化することも報告されている。また、肝細胞は均一な集団ではなく、例えば、門脈周囲にはSOX9(+)肝細胞が存在しており四塩化炭素投与で中心静脈域の肝細胞死を繰り返すと再生に寄与することが報告されている。一方、我々は、成体の胆管上皮細胞は分化可塑性が低い細胞集団であることを明らかにした。では、胆管上皮細胞は、その性質を変化させることはないのだろうか?最近、胆管上皮細胞の中でも障害に応答して増殖する能力に差があることや、肝細胞が重度に障害された場合には胆管上皮細胞から肝細胞が分化することも報告されていることから、障害の程度によっては胆管上皮細胞の分化可塑性が活性化すると考えられる。
解決すべき課題
今後は、それぞれの肝障害によって、どのような機構で肝細胞あるいは胆管上皮細胞が潜在的に持つ分化可塑性が活性化されるのかを明らかにする必要がある。また、肝細胞と胆管上皮細胞の不均一性を明らかにすることも重要な課題である。
- 谷水直樹.肝発生過程における胆管上皮細胞の分化能の変化.肝細胞研究会ホームページ ─ 研究交流
- 谷水直樹、三高俊広.肝上皮細胞による組織構造形成.生化学、84巻、第8号、658-665 (2012)
- Tanimizu N, Mitaka T. Morphogenesis of Liver Epithelial Cells. Hepatol Res, 46(10): 964-976 (2016)
- Tanimizu N, Mitaka T. Epithelial morphogenesis during liver development. Cold Spring Harb Perspect Biol, Feb 17; pil: a027862 (2017)
- Tanimizu N, Kobayashi S, Ichinohe N, Mitaka T. Downregulation of miR122 by grainyhead like-2 restricts the hepatocytic differentiation potential of adult liver progenitor cells. Development, 141(23): 4448-4456 (2014)
- Tanimizu N, Nakamura Y, Ichinohe N, Mizuguchi T, Hirata K, Mitaka T. Hepatic biliary epithelial cells acquire epithelial integrity but lose plasticity to differentiate into hepatocytes in vitro during development. J Cell Sci, 126(Ppt22): 5239-5246 (2013)
- Senga K, Mostov K, Mitaka T, Miyajima A, Tanimizu N. Grhl2 regulates epithelial morphogenesis by establishing functional tight junctions through the organization of a molecular network among claudin3, claudin4, and Rab25. Mol Biol Cell, 23(15): 2845-2855 (2012)
- Tanimizu N, Nishikawa Y, Ichinohe N, Akiyama H, Mitaka T. Sry HMG box protein 9-positive (Sox9+) epithelial cell adhesion molecule-negative (EpCAM-) biphenotypic cells derived from hepatocytes are involved in mouse liver regeneration. J Biol Chem, 289(11): 7589-7598 (2014)
- Tanimizu N, Ichinohe N, Ishii M, Kino J, Mizuguchi T, Hirata K, Mitaka T. Liver progenitors isolated from adult healthy mouse liver efficiently differentiate to functional hepatocytes in vitro and repopulate liver tissue. Stem Cells, 34(12): 2889-2901 (2016)



