(2022年1月更新)
肝機能不全に対する根治的な治療法として肝移植がある。手術方法は確立され安全性の高い手術であるが、移植に用いる肝臓は脳死患者から提供されるため、ドナー数に限りがある。脳死者数が少なく血縁者からの生体肝移植が多く行われている日本では、特にその数は限定されている。代替法として肝細胞移植が考えられ、これまで世界中で100例ほど行われている。一時的な効果は認めるものの恒久的な肝機能の正常化には成功していない。加えて、ドナーとなる肝細胞は、肝移植に不適合な肝臓から分離するため、移植に必要な細胞数を十分に確保することは困難である。
肝臓より分離した肝細胞には、取り扱いを困難にさせる他の細胞とは異なる特徴がある。
- 分離肝細胞をin vitroで増殖させることは困難であると考えられている
- 肝細胞の持つ高度な分化機能の発現を維持することができない
- 薬物代謝酵素cytochrome P450活性は培養後24時間でほぼ消失する
- 様々な培養手法が開発されているが、基本機能であるAlbumin発現を2週間維持するのは極めて難しい
- 凍結保存は可能だが、解凍後も機能させるためには厳密な凍結方法を用いる必要がある
- 解凍後の生存率は、50~60%程度である
- 継代培養ができない
我々は、これらの肝細胞培養の問題点を克服すべく研究を行ってきた。
我々が見いだした小型肝細胞は、成熟肝細胞のsubpopulationであり前駆細胞としての性質を有している(詳細は、これまでの研究を参照)。
- In vitroで増殖させることができる
- 小型肝細胞は、増殖しているときは一旦分化機能を低下させるが、肝細胞としての基本機能はほぼすべて保持しており、成熟化誘導することにより、長期間培養した後でもCYP活性などの高度な分化機能を再発現させることができる
- 1年以上の凍結保存が可能で、解凍後も小型肝細胞としての特性を維持しており、増殖し成熟化させることができる
- 培養したラット小型肝細胞を同種ラット肝臓に移植することができる
- ヒト肝臓においても小型肝細胞が存在する
我々は、小型肝細胞が分離肝細胞の持つ課題の多くを解決できることを明らかにしてきた。小型肝細胞を成熟肝細胞と同等な細胞に誘導することにより、細胞移植のドナー細胞として十分使用可能と考えている。
しかしながら、小型肝細胞を細胞移植のソースとして用いるためには、克服すべき大きな問題が残されている。
「移植に必要な細胞数をどのように確保するか」
我々は、この課題を克服できるよう研究を進めている。
(1)小型肝細胞のself-renewal能
小型肝細胞をIn vitroで増幅させるためには、小型肝細胞の特性を維持しながら継代することが必要である。下記の条件を満たす手法の開発を行っている。
- 成熟正常ラット肝細胞由来
- 無血清培養
- 肝細胞機能を保持
- 増殖能を維持
成熟ラット肝臓由来の小型肝細胞を継代培養可能な細胞外基質(ECM)の同定を行った。
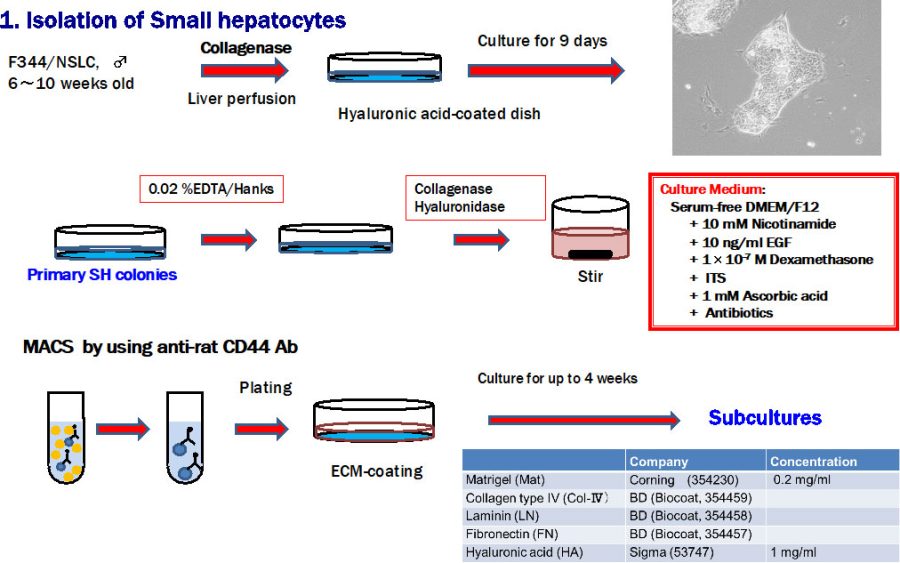
図1. ヒアルロン酸コート培養皿上で小型肝細胞コロニーを形成させ、コロニーのみを回収し酵素処理によりsingle cellsに分離する。CD44抗体を用いてソーティングをした細胞を様々なECMをコーとした培養皿上で培養し、小型肝細胞コロニー形成率を比較検討した。
剥離した小型肝細胞コロニーを攪拌しながらcollagenaseとhyaluronidaseで30分間処理するとほぼsingle cellsになる。抗CD44抗体を用いてMACS法で陽性細胞をソーティングし、ECMを塗布した培養皿上に播種する(図1)。
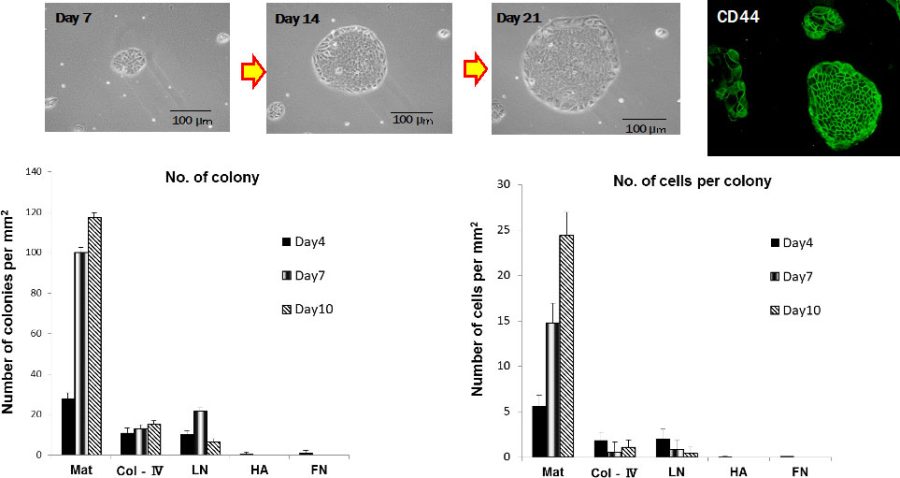
図2. Matrigel, 4型コラーゲン、ラミニン、ヒアルロン酸、フィブロネクチンでコートした培養皿上でのコロニー形成効率を調べると、Matrigel上でのみ典型的なCD44陽性小型肝細胞からなるコロニーを形成した。
培養10日後に形成されたコロニーの数と構成細胞数を計測するとMatrigel上に播種した細胞のみが典型的な小型肝細胞コロニーを形成することが分かった(図2)。
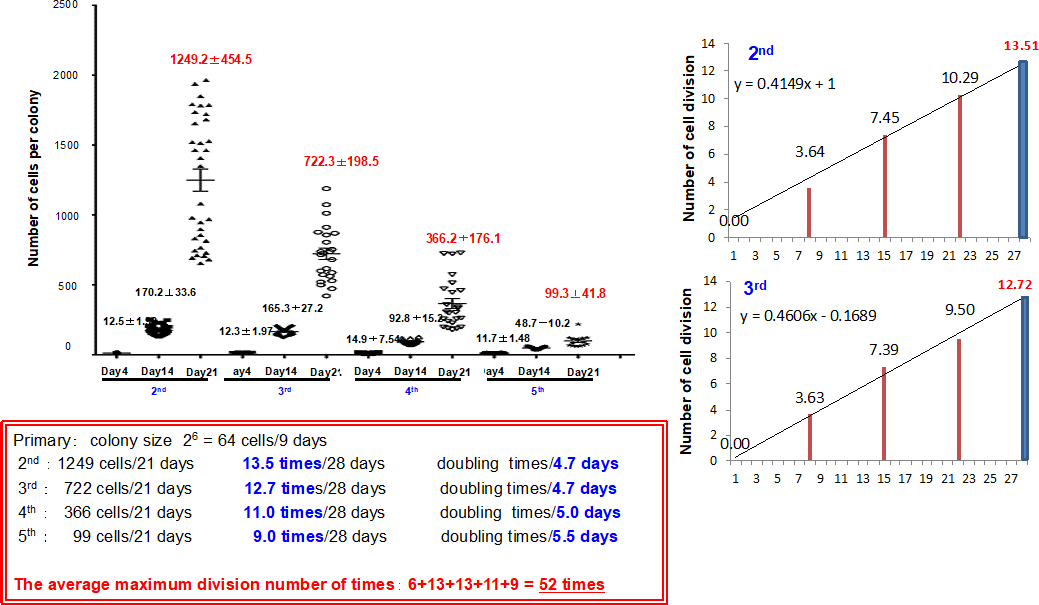
図3. Matrigelコートした培養皿で継代培養を行った。4週間培養後、trypsinを用いて剥離した細胞を新しい培養皿上に播種し4回継代を行った。定期的にコロニーの写真を撮り細胞数を計測し、細胞増殖率を推定している。28日目は、大きなコロニーになるので計測はせず3週間目までのデータから推定した。
小型肝細胞の約15%は、継代培養可能で継代毎に分裂回数は漸減するが増殖能を維持している。4回の継代により約4ヶ月間に少なくとも52回は分裂できることが分かった。
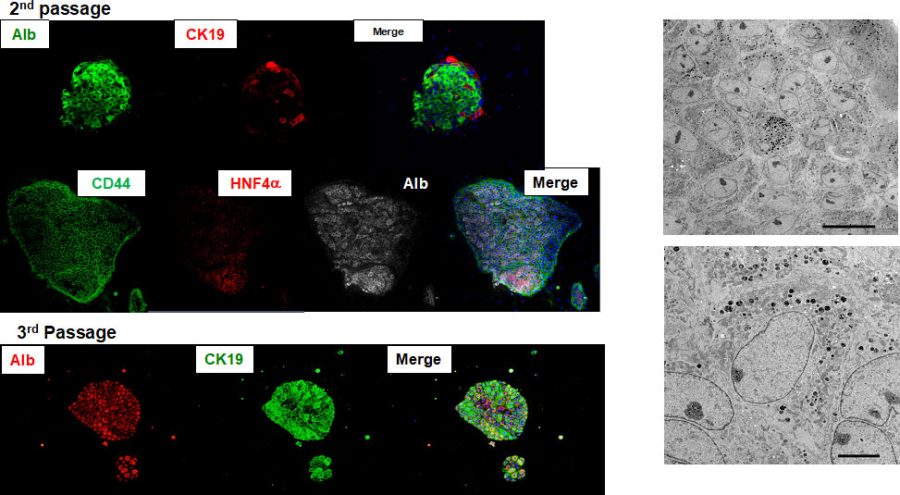
図4. 3代目(2nd passage)のCD44陽性小型肝細胞の特性を免疫染色法や透過電子顕微鏡を用いて解析した。
コロニーを構成するすべての細胞は、CD44とalbuminを発現している。超微形態的にも細胞内小胞に富んでおり、肝細胞の特徴を維持している。細胞間に毛細胆管様の構造は見られない。
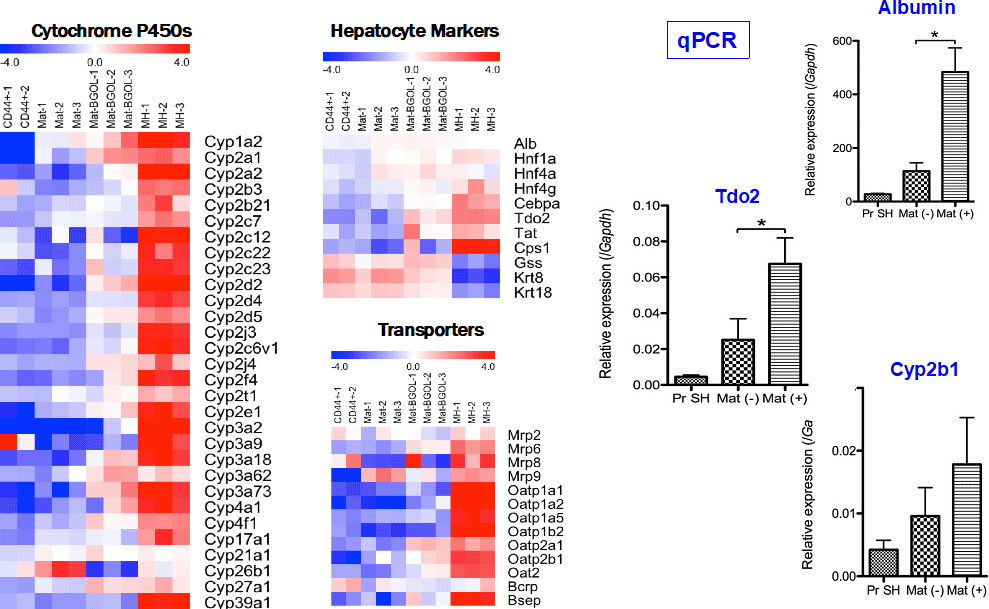
図5. 3代目の細胞を28日間培養後に単離し、RNA抽出後Microarray (Agilent)により網羅的に遺伝子発現を解析した。単離する2週間前にMatrigelを添加し成熟化誘導した(Mat-BGOL)。
CD44陽性小型肝細胞は、肝細胞としての基本を持ちMatrigel添加によりより成熟肝細胞に似た遺伝子発現パターンを示すようになる。qPCRにより高分化機能遺伝子の一つであるTdo2やCyp発現がMatrigel添加により誘導されることが分かった。
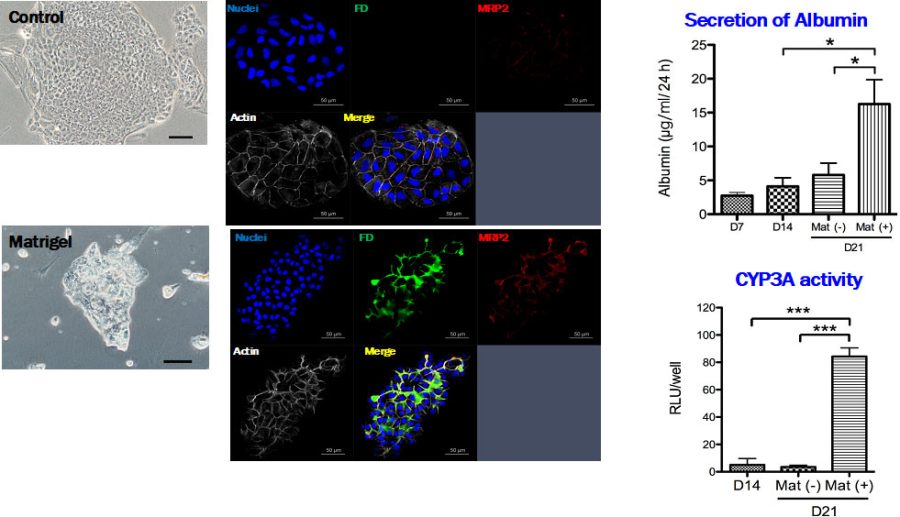
図6. Matrigel添加により成熟化し組織化したコロニーでは、毛細胆管網が形成され、投与されたFluorescence diacetate (FD)を代謝し毛細胆管中にfluorescenceを分泌する。培養液中に分泌されるalbuminは増え、CYP3活性が誘導される。
形成されたコロニーの中で、均一の小型な細胞からなる典型的なコロニーはMatrigel添加により、盛り上がり組織化する。そのようなコロニーでは毛細胆管網が形成され、胆汁を分泌している(図6)。
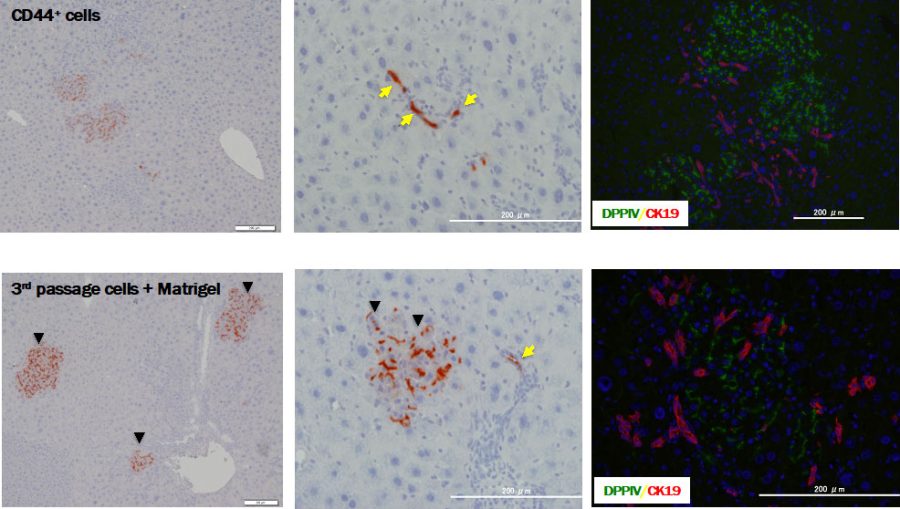
図7. 継代培養したCD44陽性小型肝細胞をRetrorsine/PHモデルラット肝臓に移植。DPPIV陽性小型肝細胞をDPPIV欠損同系ラットに移植すると、ドナー細胞は生着するとDPPIV(赤色)陽性細胞として同定できる。CD44+ cellsは、肝臓から分離培養し9日後に剥離した小型肝細胞をドナー細胞として用いた。3rd passage cells+Matrigelは、3代目の細胞を7日間Matrigel作用させてから分離し移植した。移植後30日目の肝組織像である。ドナー細胞の一部は小葉間胆管上皮細胞に分化している(黄色矢印)。
継代培養したCD44陽性小型肝細胞を同系ラット肝臓に移植しても生着しないが、Matrigel添加により成熟化誘導を掛けてから移植すると、生着し肝細胞置換できる。また小葉間胆管にも組み込まれることからBipotentialな細胞である。
一部の小型肝細胞は、Matrigel上で継代培養でき、増殖能と肝細胞としての基本機能を保持していることからself-renewal capabilityを持つ細胞といえる。我々は、この細胞を小型肝細胞の親細胞(Hepatocytic parental progenitor cells; HPPCs)と名付けた。
(2)HPPCsのself-renewal能の維持
HPPCsは、Matrigel上で継代培養可能である。Matrigelは、Engelbreth-Holm-Swarm murine sarcoma(EHS)由来で、基底膜成分であるLaminin (LN), 4型collagen、ヘパラン硫酸プロテオグリカン、Entactin(Nidogen)など細胞外マトリックス(ECM)からなる。ラミニンは、α鎖、β鎖、γ鎖をそれぞれ1本ずつ持つヘテロ3量体構造をとり、α鎖5種、β鎖3種、γ鎖2種ある。Matrigelの主成分であるLamininは、α1鎖、β1鎖、γ1鎖の3つのポリペプチド鎖からなるLN111である。一方、肝臓の主に胆管の基底膜の主要成分はα5鎖、β1鎖、γ1鎖からなるLN511である(図8)。また、LamininのレセプターであるIntegrinは、細胞膜上でα鎖とβ鎖の2つのサブユニットからなるヘテロダイマーを形成している。LN111に接着するIntegrinとしてα6β1とα7β1が, LN511に接着するIntegrinとしてα6β1, α3β1, α6β4が知られている。

図8. Lamininの構造とMatrigelの組成、生体肝臓における各Laminin α鎖の存在部位
Matrigel上で継代培養したCD44陽性SHsを、LN111を塗布した培養皿に播種し、1時間静置後、付着しなかった細胞を回収しLN511を塗布した培養皿に播種した。コントロールとしてMatrigelを塗布した培養皿を用いた(図9)。
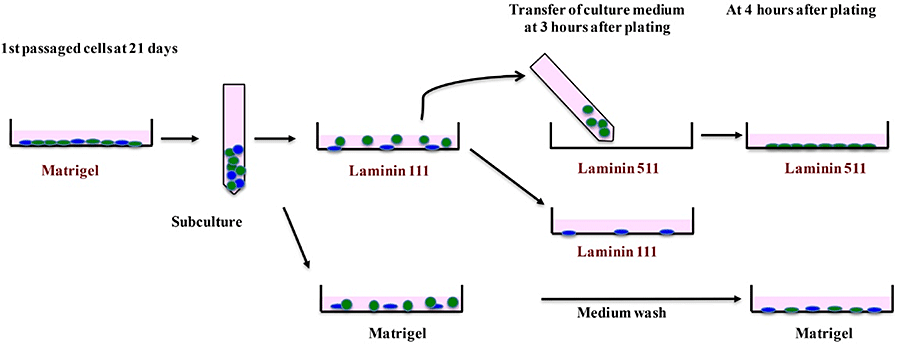
図9. HPPCsのLaminin分子種依存性の検討。Matrigel上で21日間培養した初代継代細胞をtrypsinで分離し、Laminin111塗布培養皿に播種し、1時間後に培養液を回収し、そのままLaminin511塗布培養皿に播種した。Laminin111に接着しなかった細胞がLaminin511に接着しコロニー形成するか検討した。
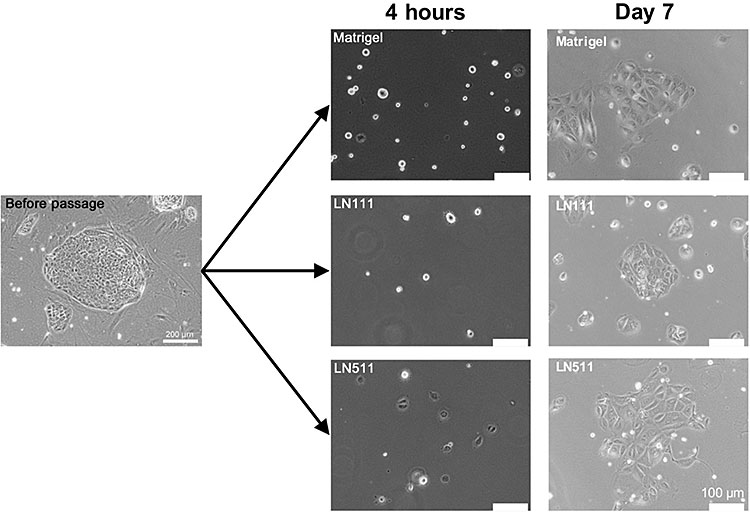
図10. 細胞分離4時間後に培養液を交換し、接着していない細胞を取り除く。1週間培養しコロニー形成能を調べた。
LN111上にはHPPCsのコロニー形成を認めたが、LN511上ではHPPCsのコロニー形成が認められず、細胞質が広がった大型の細胞から構成されるコロニーが認められた。Matrigel上では、LN111及びLN511上の見られたどちらのコロニーも認められた(図10)。
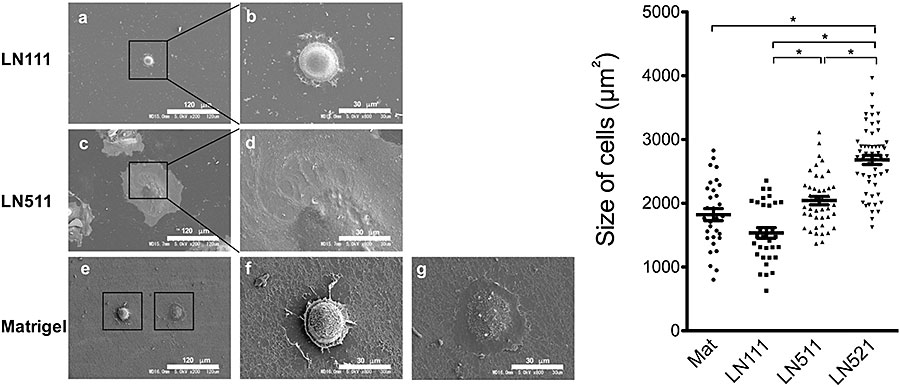
図11. 播種後1日目の細胞形態と大きさ。走査電子顕微鏡像(左図)と細胞の大きさの分布図(右図)。Scattered plots、Barは平均値。*p<0.05
走査電子顕微鏡写真でそれぞれの細胞を観察すると明らかに形態が異なっている。HPPCsは、比較的球形の形態を保っているのに対して、LN511上の細胞は細胞質が拡がり細胞の厚みが少ない扁平な細胞形態をとっていた(図11)。LN511に接着する細胞は、LN521にも同様に接着することからLaminin α5鎖依存性と考えられる。
LN111及びLN511に接着する細胞の遺伝子発現をmicroarray (Agilent)で網羅的に解析した。肝細胞特異的遺伝子及び幹細胞関連遺伝子を選択して比較した(図12)。
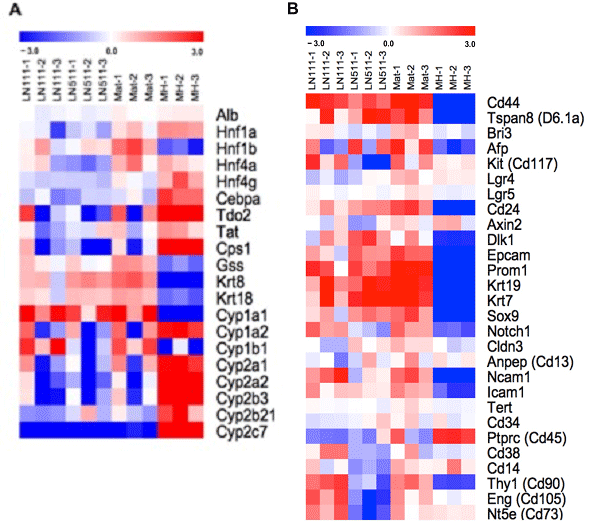
図12. 肝細胞特異的遺伝子(A)及び幹細胞関連遺伝子(B)の発現。Microarray (Agilent)を用いた。相対的な発現を示す。
LN111依存性のHPPCsもLNα5鎖依存性の細胞も肝細胞特異的遺伝子を発現しているが、HPPCsの方が幹細胞関連遺伝子の発現が高い傾向があり、LNα5鎖依存性の細胞は胆管上皮細胞関連遺伝子の発現が高い傾向を示していた。Axin2, Lgr4/5,Tertの発現は、いずれの細胞も低くLineage tracing法を用いたマウスで報告されているself-renewal能を持つ肝細胞とは異なるPopulationと考えられた。
LN受容体であるIntegrin(Itg)分子種の発現を調べた(図13)。
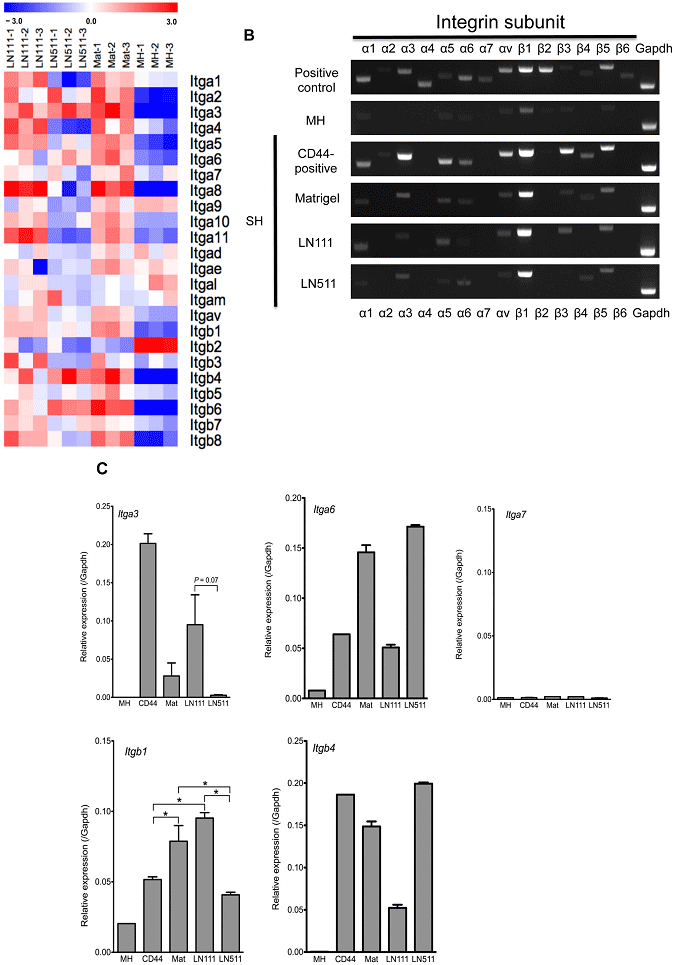
図13. Microarray (Agilent)を用いたIntegrin分子の網羅的発現解析及びPCRによる発現の確認。RT-PCR (B)、RT-qPCR (C)。
HPPCsでは、Itgα3及び β1鎖の発現がLNα5鎖依存性細胞より有意に高く、β4鎖の発現はLNα5鎖依存性細胞より低かった。
免疫染色でそれぞれの細胞におけるタンパク質の発現を確認すると、HPPCsではItg α6b1が発現し、Itg β4発現は認められなかった。一方、LNα5依存性のコロニーにおいてもItg α6β1発現を認めたが、Itg β4が強く発現していた(図14)。
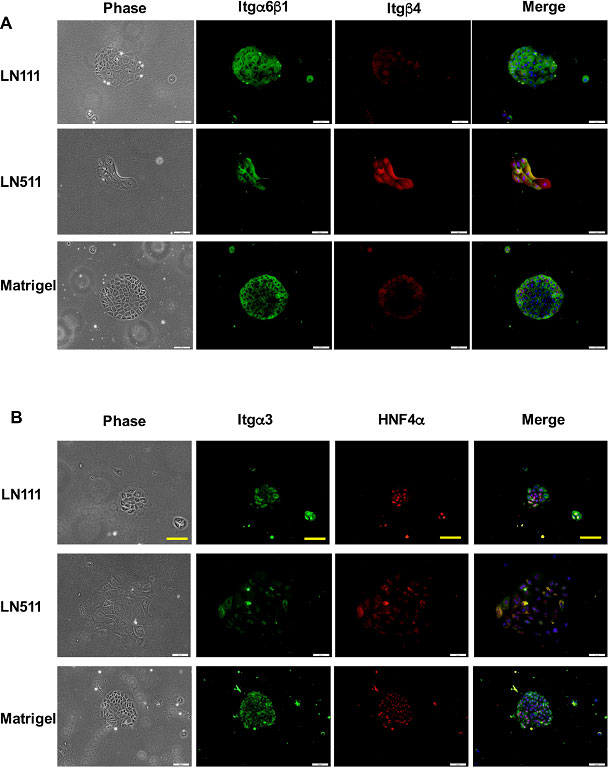
図14. LN111依存性及びLN511依存性細胞のIntegrin分子種の発現。特異的抗体を用いた蛍光免疫3重染色を示す。肝細胞マーカーとしてHNF4α、核をDAPIで染色。Bar; 100μm
HPPCsはIntegrin α6β1の発現が高く、LNα5鎖依存性細胞での発現が低いことから抗Integrin α6β1抗体を用いて細胞をソーティングし、HPPCコロニーを形成するか調べた(図15)。
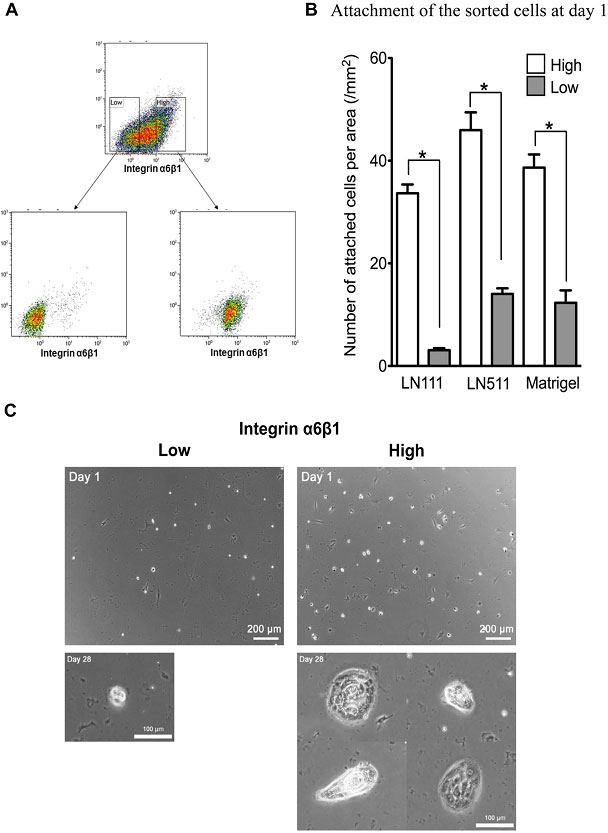
図15. 分離した初代継代細胞をAnti-Integrin α6β1抗体を用いてMACS法でソーティングし、培養した。
Integrin α6β1high細胞は、HPPCsコロニーを形成したが、Integrin α6β1low細胞はコロニーを形成しなかった(図15C)。
LN111依存性細胞のIntegrin α3の発現も高いことから、Integrin α6β1high細胞を更にIntegrin α3抗体を用いてソーティングした(図16)。
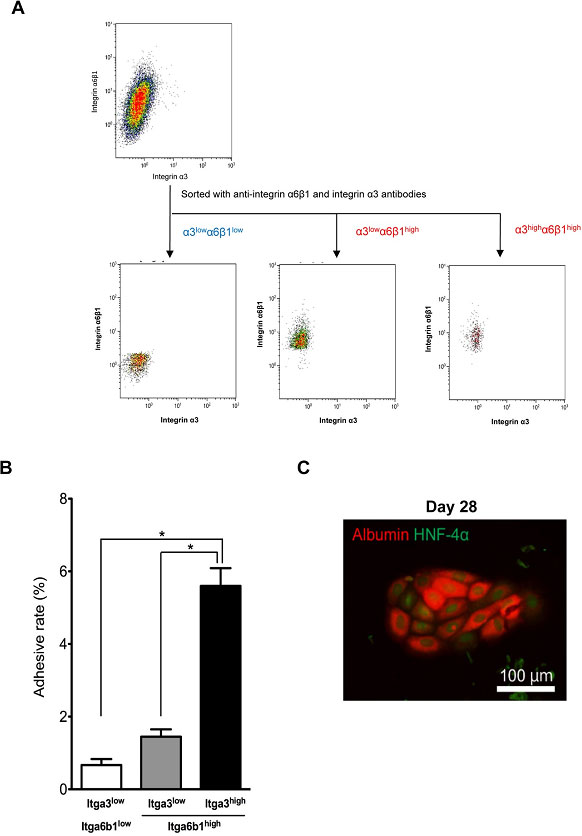
図16. Integrin α6β1high細胞をanti-Integrin α3抗体を用いてMACS法にてソーティングした。
Integrin α3highα6β1high細胞がHPPCsコロニーを形成した(図16B,C)。
中和抗体を用いてHPPCsコロニー形成が阻害されるか検証した(図17)。
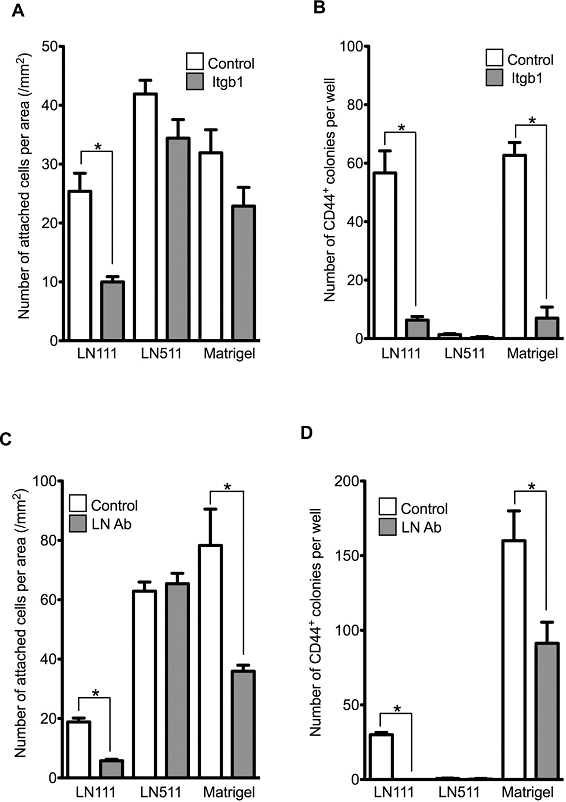
図17. 抗integrin β1抗体と抗laminin111抗体を用いて、接着抑制及びHPPCsコロニー形成抑制効果を検討。
HPPCのコロニー形成は、抗Integrin β1抗体及び抗LN111抗体によって抑制された。一方、LNα鎖依存性のコロニー形成は、どちらの抗体によっても抑制されなかった(図17)。
HPPCsのself-renewal能は、Integrin β1及びLaminin111依存性であることが分かった。
Matrigel及びLN111上で培養をすると、典型的なHPPCコロニーが出現する一方、LN511依存性の形態を示すコロニーの形成も少なからず認められる。HPPCsがLNα5鎖を分泌していると考えられるためECMの遺伝子発現を調べた。
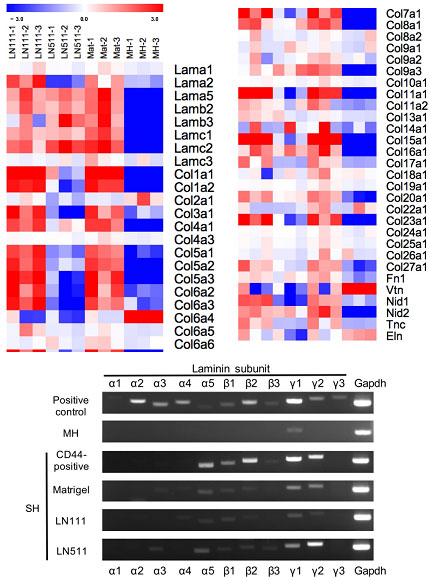
図18. ECM遺伝子の網羅的発現解析。Microarray (Agilent;上図)及びRT-PCR(下図)
HPPCsは、LN511依存性細胞に比べて明らかに多くの種類のECM遺伝子を発現している。LNα5, β1, γ1鎖を発現していることからLN511を分泌し、LN511依存性細胞の増殖を支持していると考えられる。
HPPCsの成熟化が誘導可能かどうか検討した。
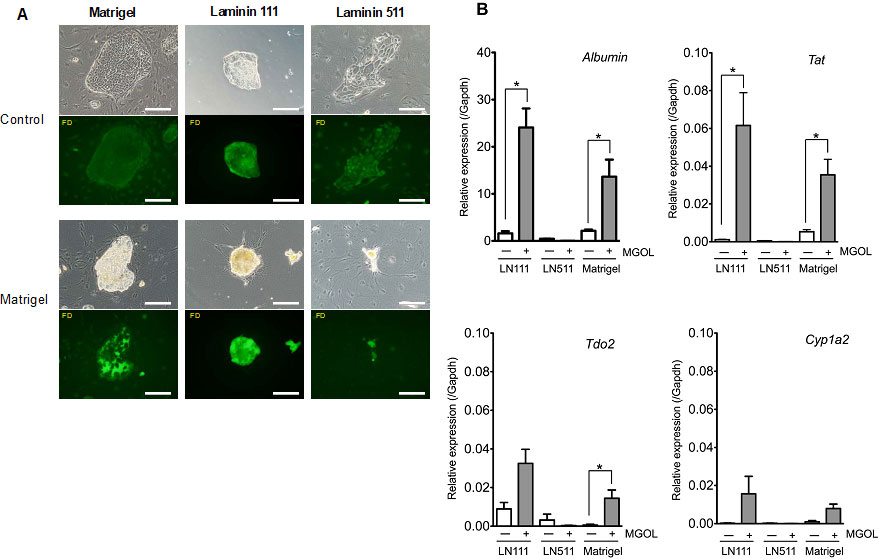
図19. LN111及びLN511上で形成されたコロニーにMatrigelを投与し、成熟化誘導可能か検討。(A)Fluorescence diacetate (FD)を投与し、毛細胆管網の形成を検討。(B)RT-qPCRによる遺伝子発現解析。*p<0.05
LN111及びMatrigel上に形成されたHPPCコロニーは、Matrigel投与により3次元化し、毛細胆管網を形成したが、LN511上に形成されたコロニーはMatrigel投与によりコロニーが縮小し毛細胆管形成は認められなかった。Matrigel投与によりHPPCsのAlbuminやTAT遺伝子発現は有意に増加した。
解決すべき課題
- Self-renewal能を有するHPPCsの増幅法の確立
- LN511依存性のDaughter細胞の成熟化誘導法の確立
- Ishii M, Kino J, et al. Hepatocytic parental progenitor cells of rat small hepatocytes maintain a self-renewal capability after long-term culture. Scientific Reports, Apr 11; 7: 46177 (2017) doi: 10.1038/srep46177
- Kino J, Ichinohe N, Ishii M, Suzuki H, Mizuguchi T, Tanimizu N, Mitaka T. Self‐Renewal Capability of Hepatocytic Parental Progenitor Cells Derived From Adult Rat Liver Is Maintained Long Term When Cultured on Laminin 111 in Serum‐Free Medium. Hepatol Commun, 2019 Nov 2; 4(1): 21-37 (2019) doi: 10.1002/hep4.1442. eCollection 2020 Jan



