(2022年1月更新)
(1)ガラクトサミンを投与した薬剤性障害ラット肝臓から分離したThy1陽性細胞移植による内在性肝前駆細胞の活性化と肝再生
我々は、細胞移植のドナー細胞として肝幹細胞や肝前駆細胞が適しているか検討してきた。ガラクトサミン投与による急性障害肝臓から分離したThy1陽性細胞を肝幹細胞、CD44陽性細胞を肝前駆細胞としてRetrorsine/PHモデルラット肝臓に移植し、生着率・置換率を成熟肝細胞移植と比較検討した。Thy1陽性細胞では生着率・置換率共に極めて低く、移植2ヶ月後にはほぼ消失する。CD44陽性細胞の場合は、成熟肝細胞よりは低いが置換効率は高く1年後も生着している細胞が多い(Kon J et al, 2009; Ichinohe N et al, 2012)。
その過程で、Thy1陽性細胞を移植したラットでは肝臓が明らかに大きくなることに気がついた(図1)。Thy1陽性細胞は移植しても肝臓内にはとどまらず、移植2日目の肝臓には極めて少数の細胞を認めるだけであるにもかかわらず、2週間後には肝臓は明らかに大きくなっていた。何故だろうか?
我々はその機序の解明を目指して研究を行った。
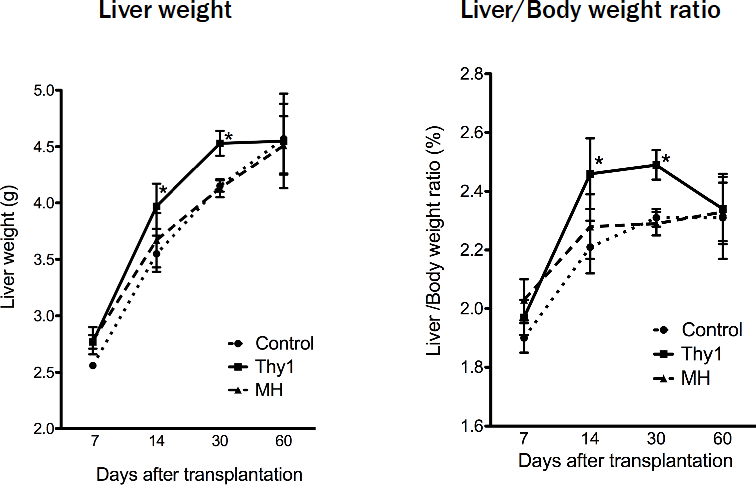
図1. 細胞移植したレシピエントラット肝重量とL/B比。Thy1陽性細胞を移植したラットでは、コントロールや成熟肝細胞を移植したラットより優位に肝臓が大きくなっていて、移植後60日目でコントロールと同じ大きさになる。
移植した肝臓の組織を調べると、Thy1陽性細胞を移植した肝臓ではSmall-hepatocyte like progenitor cells (SHPCs)と呼ばれる肝前駆細胞のクラスターが明らかに増えていた(図2)。
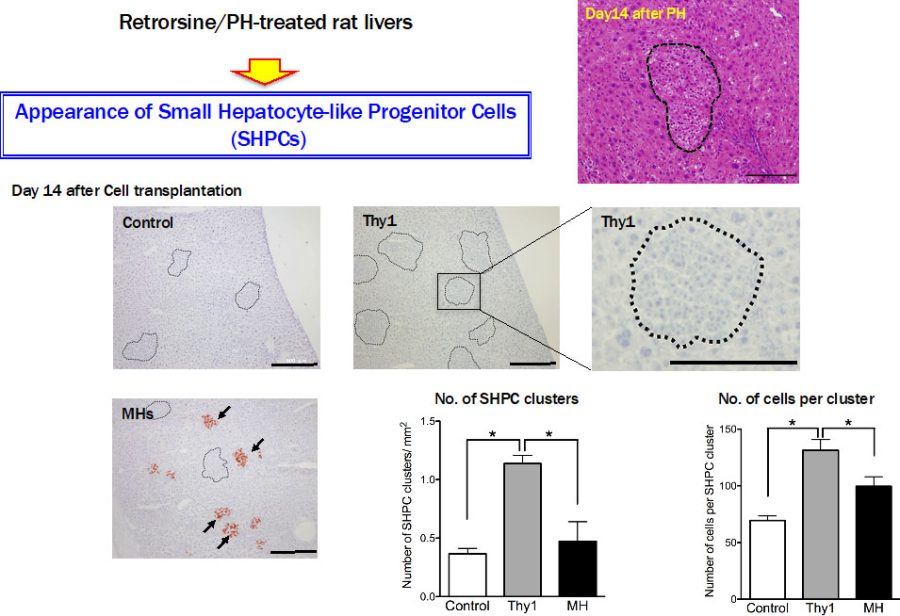
図2. ガラクトサミン投与2日目のラット肝臓から分離したThy1陽性細胞(DPPIV+; 5×105 cells)を同系ラット肝臓(DPPIV-)に脾臓経由で移植した。2週間後の肝組織像。DPPIV染色を行い、ドナー細胞の生着を見ると成熟肝細胞(MHs)を移植した肝臓にはドナー細胞が小さな細胞集塊(→)を作り増殖しているが、Thy1陽性細胞を移植した肝臓にドナー細胞は認められない。小型肝細胞から成るSHPCs(拡大図)の数と構成細胞数をカウントした。コントロールに比較し、Thy1陽性細胞を移植した肝臓ではSHPCsの数は3倍、細胞数は2倍増えていた。
肝臓が大きくなったのは、内在性の肝前駆細胞であるSHPCsが増殖によると考えられた。SHPCs増殖促進機序を調べるために、Laser microdissection法を用いてSHPCsを単離し、遺伝子発現を網羅的に解析した。
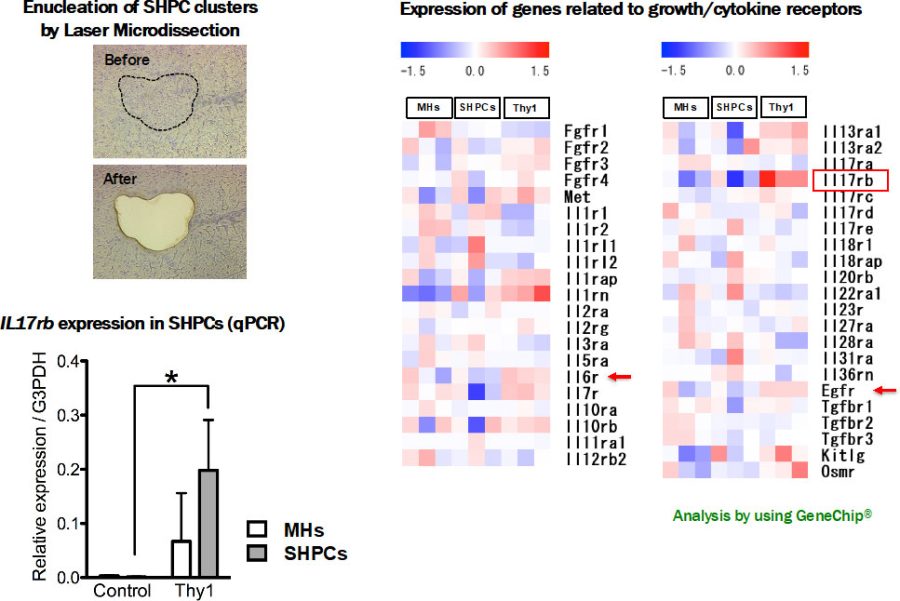
図3. Thy1陽性細胞移植及びコントロール肝臓に出現したSHPCsにおける増殖因子・サイトカイン受容体の遺伝子発現を網羅的に解析すると、IL17 receptor Bが顕著に発現していた。
IL17RBシグナルがSHPCの増殖に重要な働きをしていると考えられた。IL17RBのリガンドとしてIL17BとIL25がある。それぞれのサイトカインを産生している細胞を調べると、IL17Bは類洞内皮細胞が、IL25はマクロファージ(Kupffer細胞)が産生していることが分かった。
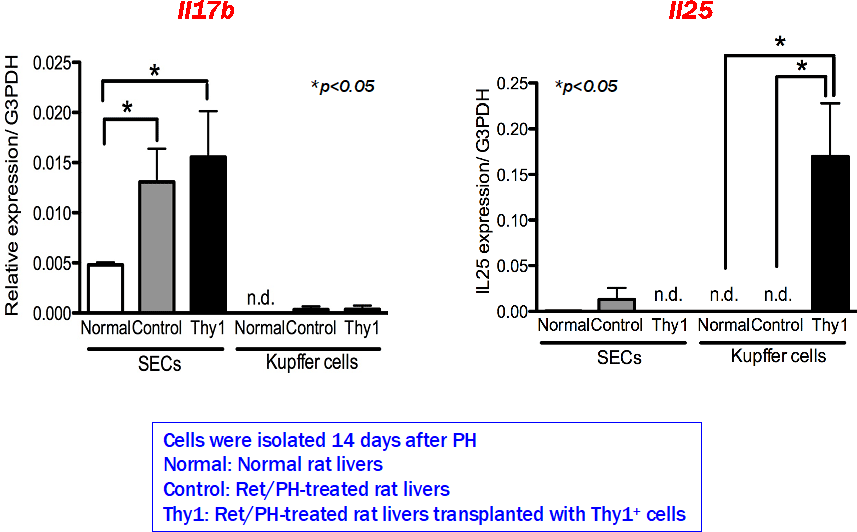
図4. Thy1陽性細胞を移植したラット肝臓から細胞を分離し、SE1抗体とCD68抗体を用いて類洞内皮細胞(SECs)とKupffer細胞をソートし、遺伝子発現を調べた。
移植したThy1陽性細胞が分泌する液性因子が類洞内皮細胞やKupffer細胞、SHPCsに作用し、IL17B, IL25, IL17RBを発現させるか検討した。液性因子としてExtracellular vesicles (EVs)を抽出し、それぞれの培養細胞に作用させた。
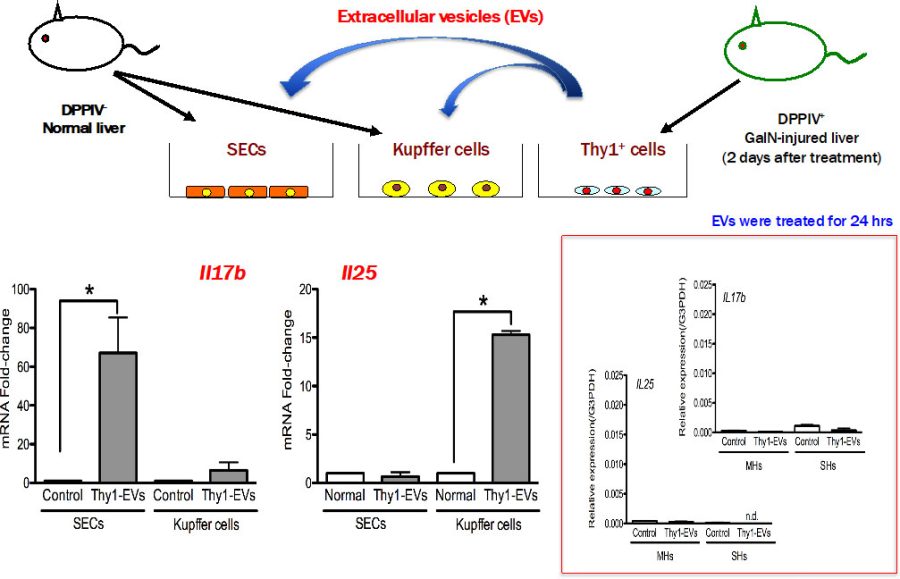
図5. 培養した類洞内皮細胞(SECs)及びKupffer細胞にThy1陽性細胞の培養上清から分離したEVs (Thy1-EVs)を作用させて、遺伝子発現を調べた。
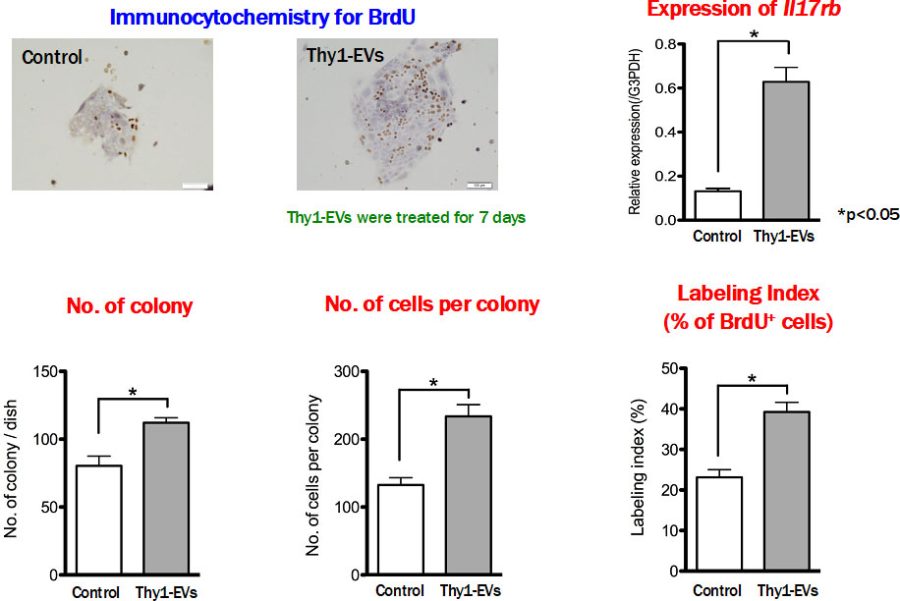
図6. 培養した小型肝細胞にThy1-EVsを作用させ、IL17rbの発現とコロニーの増殖を調べた。
移植したThy1陽性細胞が分泌するEVsが内在性肝前駆細胞であるSHPCsの増殖を促進していると考えられた。
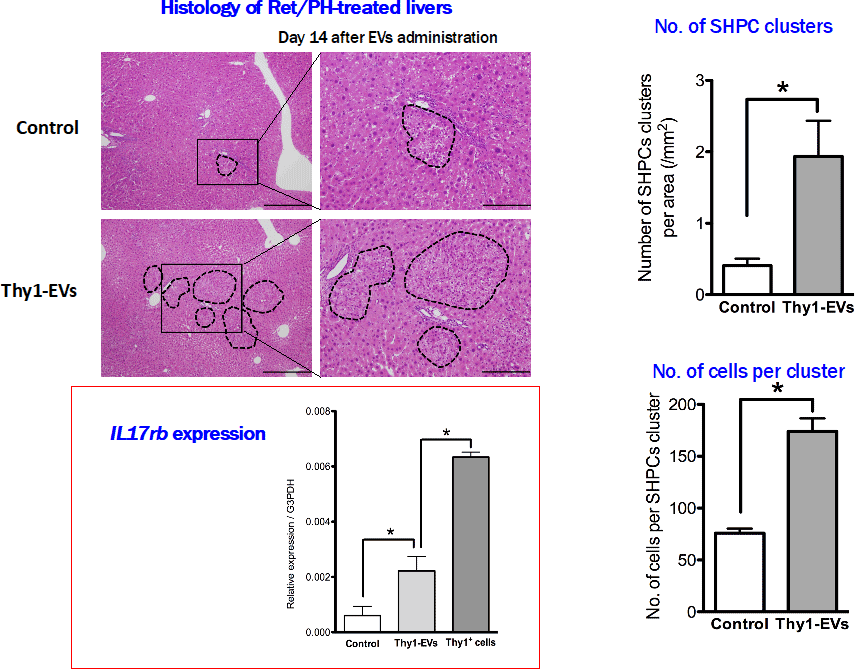
図7. Thy1-EVsをRetrorsine/PHモデルラット肝臓に投与した。Thy1-EVsを投与した肝臓のSHPCsではIL17rb発現が促進され、SHPCs数、構成細胞数も明らかに増加した。
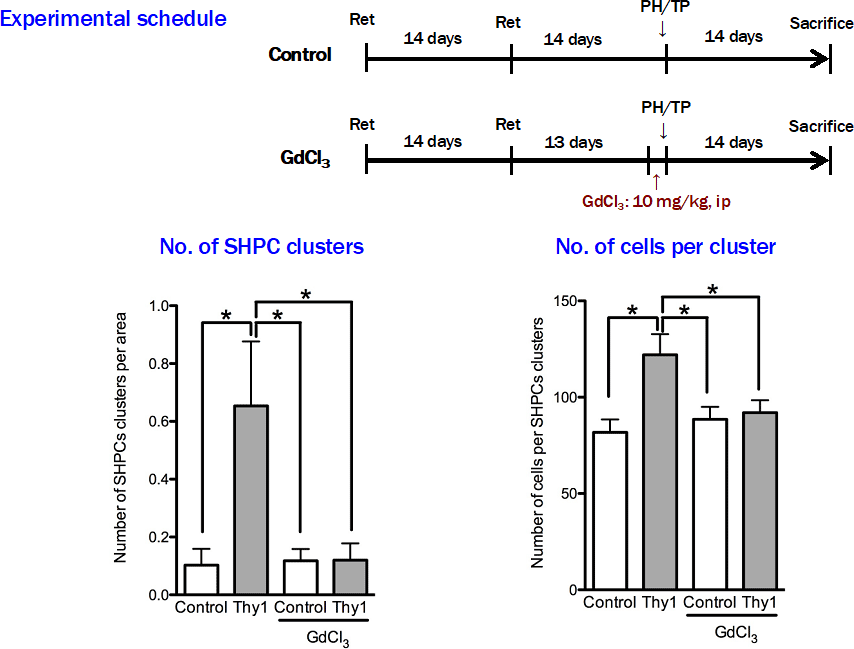
図8. 塩化ガドリニウム(GdCl3)を投与し、Kupffer細胞の活性を抑制したラットにThy1陽性細胞を移植し、SHPCsの増殖活性を調べると、GdCl3を投与したラットではSHPCsの増殖は抑制されていた。
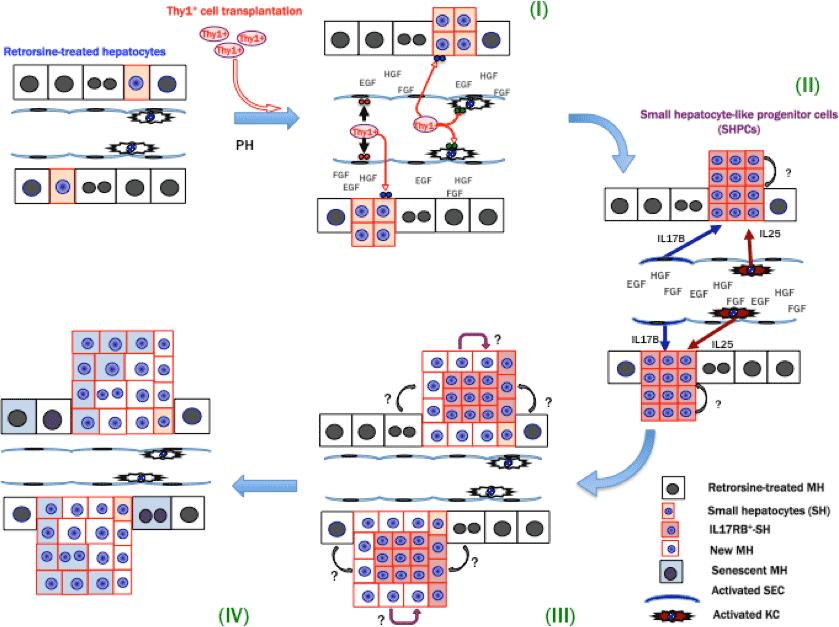
図9. 研究結果をイラストで示した。
この結果をまとめると、ガラクトサミンによって誘導されたThy1陽性細胞が分泌するEVsは内在性肝前駆細胞であるSHPCsの増殖を誘導する。EVsは類洞内皮細胞及びKupffer細胞、SHPCsに作用し、それぞれIL17B, IL25, IL17RBの発現を誘導する。SHPCsはIL17RBシグナルを介して増殖していることが分かった。増えたSHPCsは1ヶ月を過ぎると細胞老化に陥り、徐々に減少し2ヶ月後にはコントロールと同様の大きさの肝臓になることが分かっている。
(Ichinohe N et al. Stem Cells, 2017)
(2)ラット骨髄由来Thy1陽性細胞投与による内在性肝前駆細胞の活性化と肝再生
骨髄間葉系細胞(Bone marrow-derived mesenchymal cell; BM-MCs)もThy1を発現することが知られている。GalN投与肝臓由来Thy1陽性細胞と同様の肝再生促進作用を持つか検討した。
ラット骨髄から分離した骨髄細胞を培養し、培養皿に接着した細胞を14日間培養し、剥離した細胞を脾臓経由でRet/PHモデルラット肝臓に移植した。
移植する細胞の細胞膜表面マーカーの発現を示す。
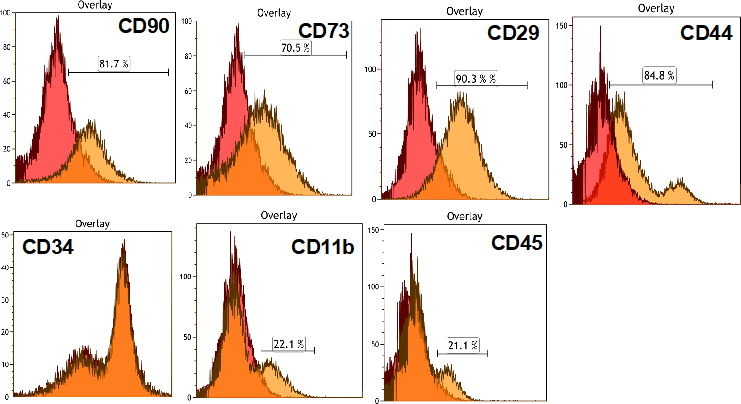
図10. CD90(Thy1)を発現する細胞は約80%、CD90+/CD73+/CD29+/CD44+/CD34-/CD11-/CD45-細胞が主たるPopulationであり、間葉系幹細胞の特性を有する細胞も含まれている。
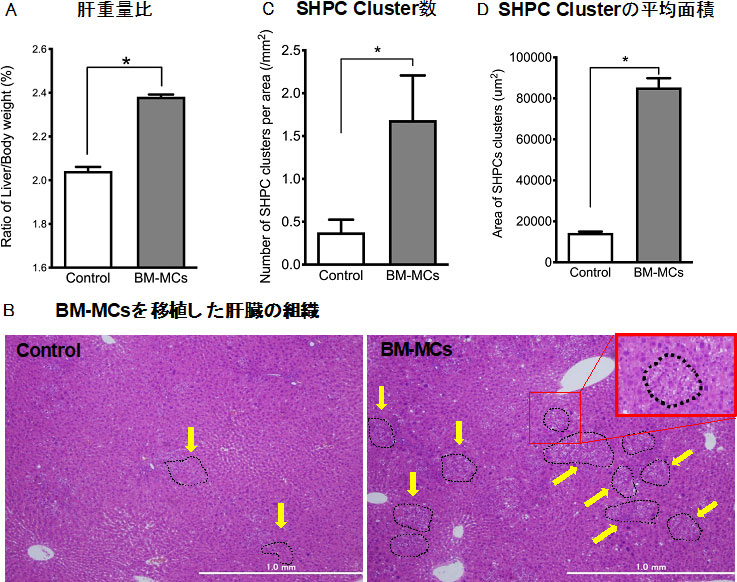
図11. BM-MCs(5×105 cells)を脾臓経由でRet/PHモデルラット肝臓に移植した。(A)移植2週間目のLiver/Body weight ratioを示す。Recipient liverが有意に肥大している。(B)H&E染色。SHPC clusterを点線で囲む(矢印)。赤線で囲った四角は拡大像。(C)単位面積当たりのSHPC cluster数、(D)SHPC clusterの平均面積。*p<0.05
BM-MCsも障害肝臓由来Thy1陽性細胞と同様に内在性肝前駆細胞を活性化し、肝再生を促進した。BM-MCsが分泌する細胞外分泌顆粒(EVs)がSHPCsの増殖を促進するか検討した。
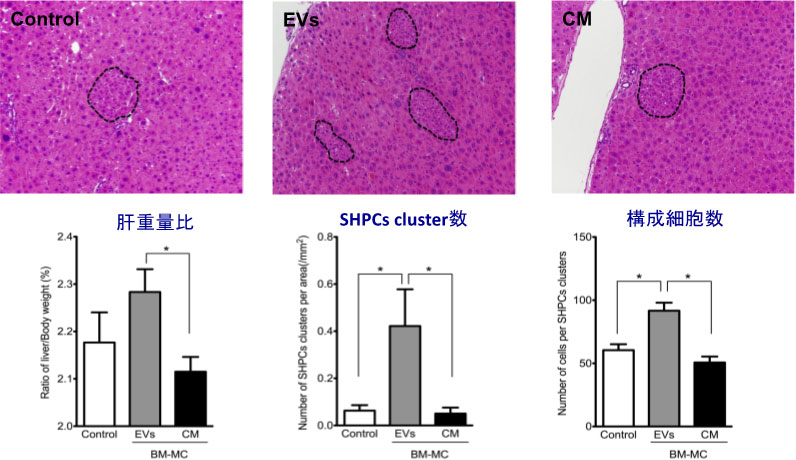
図12. BM-MCsの培養上清を超遠心後、沈殿物(EVs)と上清(CM)を脾臓経由でRet/PHモデルラット肝臓に投与した。移植2週間目の肝組織像(H&E染色)。SHPC clusterを点線で囲んでいる。肝重量比、SHPC cluster数、Cluster当たりの細胞数を示す。P<0.05
BM-MCsの産生するEVsが内在性肝前駆細胞を活性化し、肝再生を促進することが判った。障害肝臓から分離したThy1陽性細胞と同じようにIL17RBシグナルを介してSHPCsを活性化しているかどうか検討した。
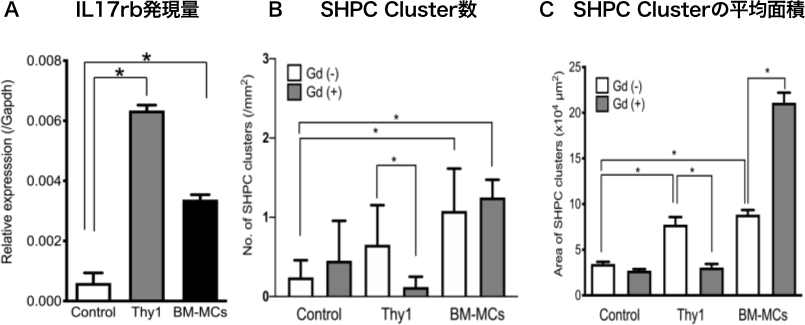
図13. (A)移植2週間目のSHPCsに発現するIL17rb遺伝子発現。マクロファージの活性を抑制する塩化ガドリニウム(Gd)を移植24時間前に投与した。移植2週間目のSHPC cluster数(B)と面積(C)をThy1陽性細胞移植とBM-MCs移植肝臓で比較した。
BM-MCs移植によるSHPCsの増殖促進作用は、IL17rb遺伝子の発現誘導が障害肝由来Thy1陽性細胞の場合と比較して明らかに低いことから、IL17RBシグナル以外の作用機序もある可能性が考えられた。障害肝由来Thy1陽性細胞による肝再生促進においてクッパー細胞が重要な働きをしている。BM-MCsの場合も同様にクッパー細胞が関与しているか検討するために、貪食活性を抑制する塩化ガドリニウムを移植24時間前に投与し、障害肝由来Thy1陽性細胞及びBM-MCsを移植してSHPC cluster形成能を比較検討した。障害肝由来Thy1陽性細胞を移植した肝臓におけるSHPC cluster形成は有意に抑制された一方で、BM-MCsを移植した肝臓では、SHPC cluster数に変化はなかったが個々のClusterの面積が有意に大きくなった。この結果は、障害肝由来Thy1陽性細胞移植によるSHPCsの増大は、クッパー細胞を介してIL17RBシグナルが活性化される間接的な作用が主体であるのに対して、BM-MCsによる増大は、SHPCsに対する直接作用が主体である可能性が示唆された。また細胞移植により増殖したSHPCsの遺伝子発現を解析すると、図14で示すようにBM-MCs移植により誘導されたSHPCsでは、障害肝由来Thy1陽性細胞に比較して、より成熟肝細胞に近い遺伝子発現パターンを示すことが判った。
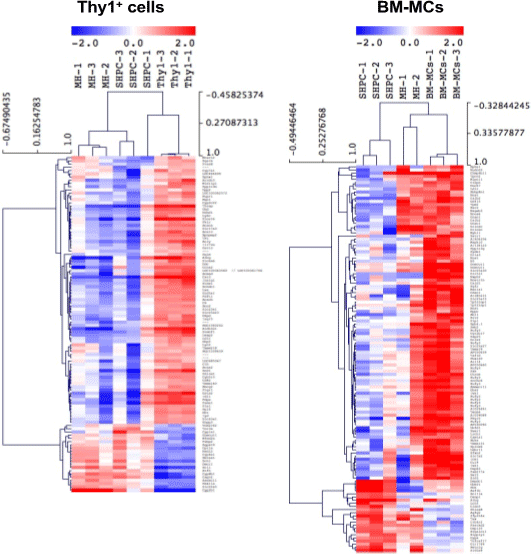
図14. BM-MCs及び障害肝由来Thy1陽性細胞移植により誘導されたSHPCsの遺伝子プロファイルのクラスタリング解析。
BM-MCsが分泌するEVsが肝前駆細胞の増殖を促進するか分離したSHsを用いて解析した。
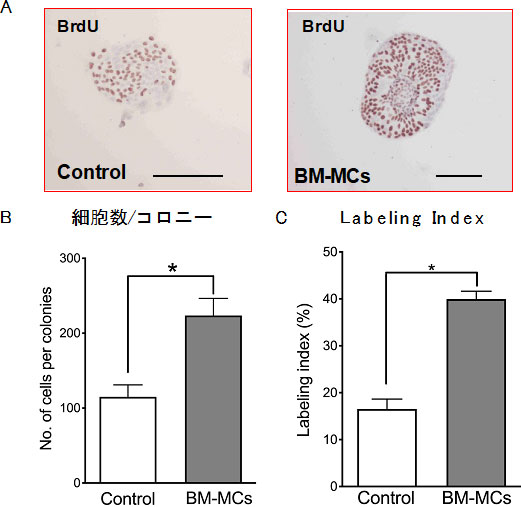
図15. BM-MCsと小型肝細胞(SHs)をCell strainerを用いて間接共培養し、SHsに対する増殖効果を調べた。(A)BrdUを24時間投与し、固定後抗BrdU抗体を用いて免疫染色した。(B)SHコロニーの構成細胞数を比較した。(C)BrdU陽性細胞の割合を計測した。*p<0.05
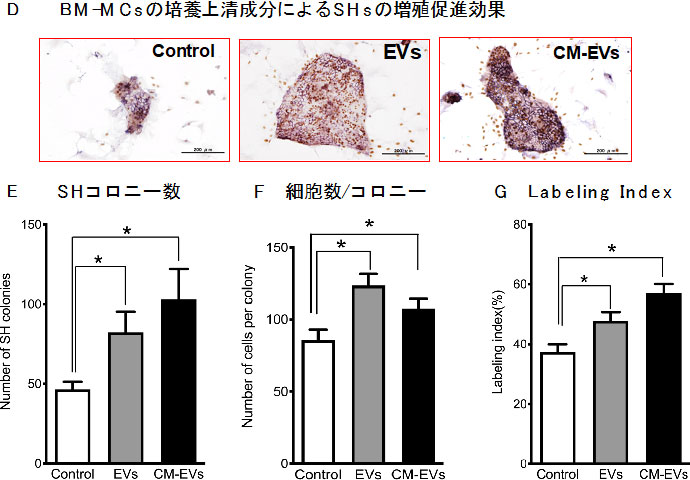
図16. BM-MCsの培養上清を超遠心後、沈殿物(EVs)と上清(CM-EVs)に増殖促進因子があるか検討した。*p<0.05
EVs及びCM-EVsどちらにもSHsに対する増殖促進因子が含まれていることが分かった。BM-MCsが分泌するEVsに含まれる因子をmicroRNA arrayを用いて解析した。
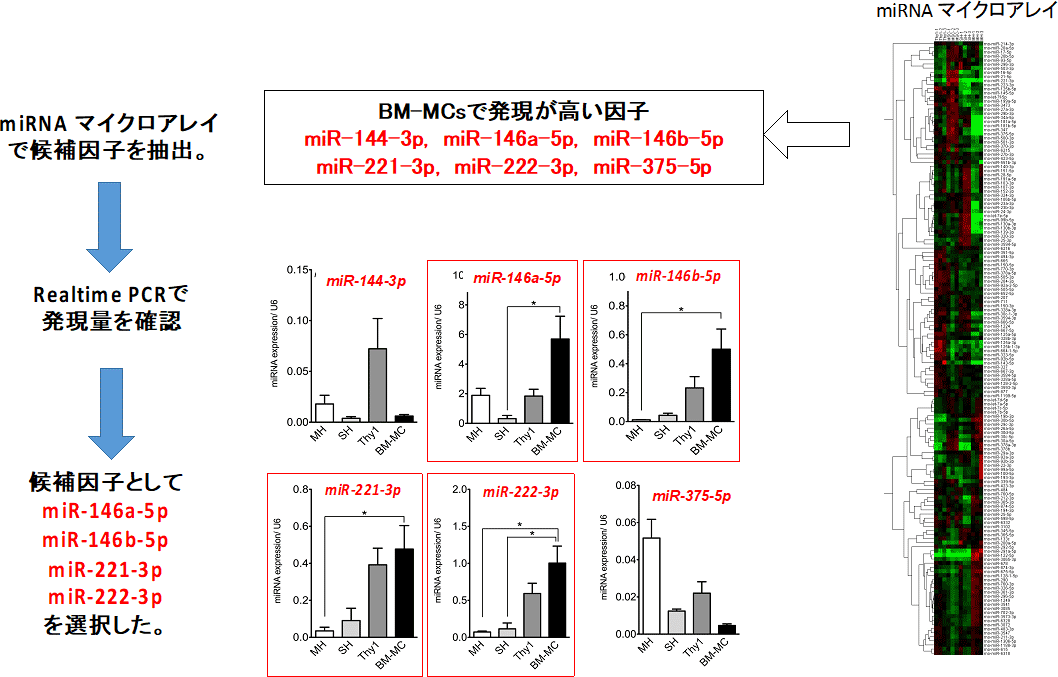
図17. miRNA arrayにより発現の高いmiRNAsを選択し、それぞれの細胞における発現をrealtime PCRにて確認した。
BM-MCs由来EVsに多く含まれているmiRNAを抽出し、選択したmiRNAのmimicをSHsに投与し、コロニー形成を検討した。
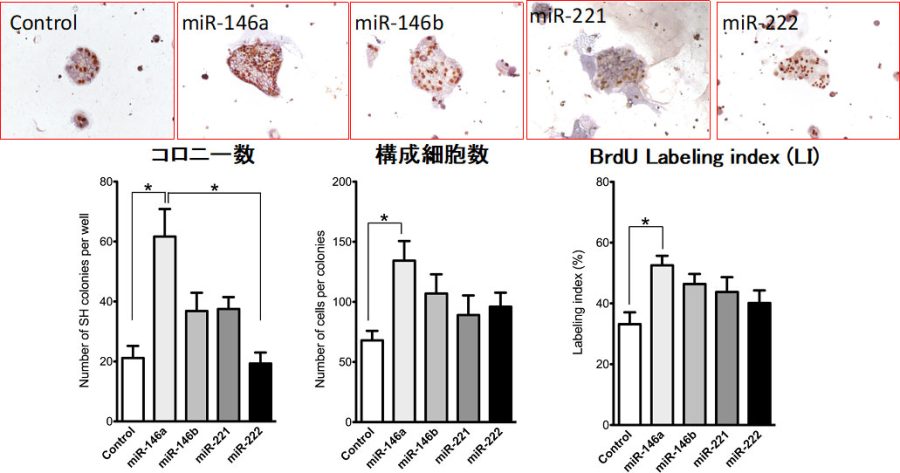
図18. 選択した4種のmiRNA mimicをSHsの培養液に投与し、コロニー数、コロニー当たりの細胞数、labeling indexを計測した。*p<0.05
miR-146a-5pのみがSHsの増殖を促進した。
次に、EVsに含まれるサイトカインを解析した。
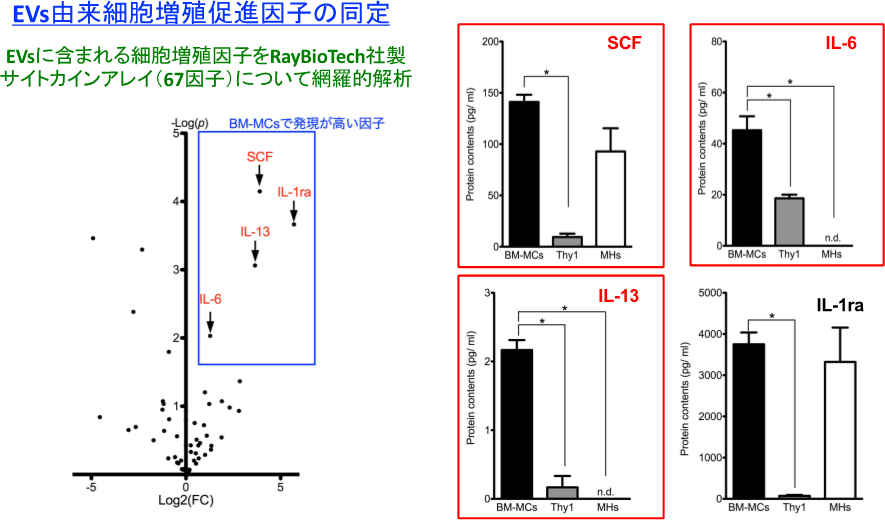
図19. EVs中に含まれるサイトカインを解析後、発現量の多い4因子についてそれぞれの細胞における発現量をrealtime-PCRで確認した。*p<0.05
SCFとIL-6、IL13の発現が多かった。それぞれのサイトカインをSHsに投与し増殖促進効果があるか検討した。
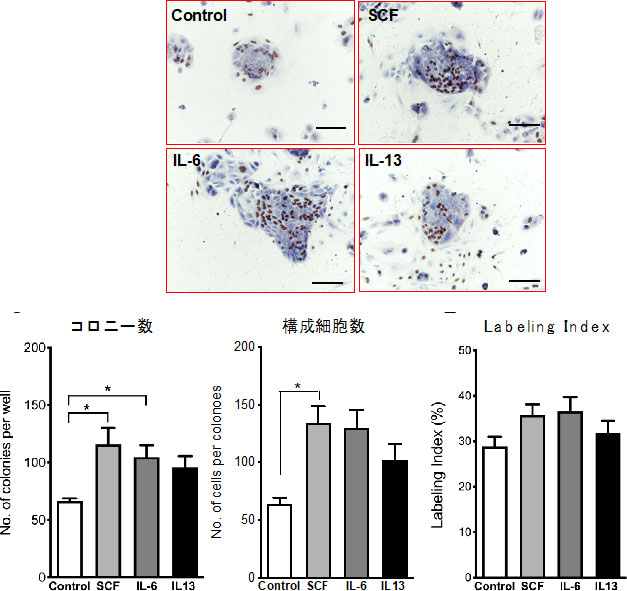
図20. SHsにSCF, IL6, IL13を投与し、増殖促進効果を検討した。*p<0.05
SCF及びIL6にSHsの増殖促進効果を認めた。
miR-146a-5pとサイトカインの相乗効果について検討した。
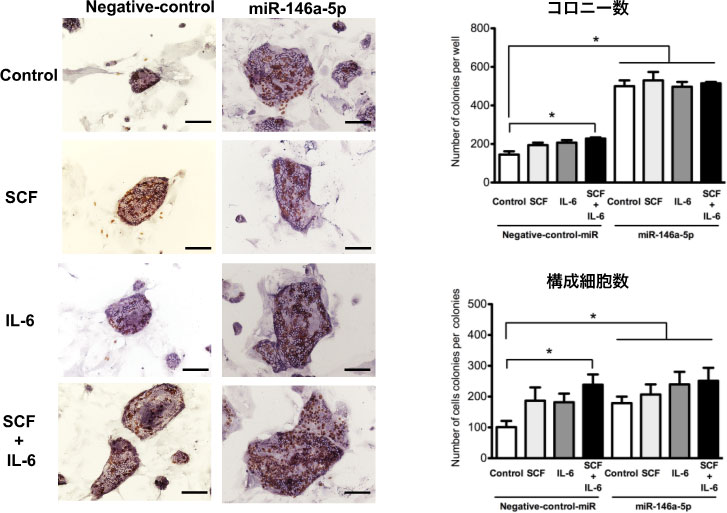
図21. miR-146a-5p mimicの有無によるサイトカインの相乗効果。SCF (20μg/ml)、IL6(20μg/ml)単独または併用して培養液に添加。*p<0.05
miR-146a-5p非存在下では、SCFとIL6を併用した場合に有意に促進効果を認めたが、miR-146a-5p存在下では促進効果は認めなかった。
EVsに含まれるmiR-146a-5pがSHPCsの増殖を直接促進しているか検討するために、miR-146a-5pを強制発現させたBM-MCsの分泌するEVsを投与した。
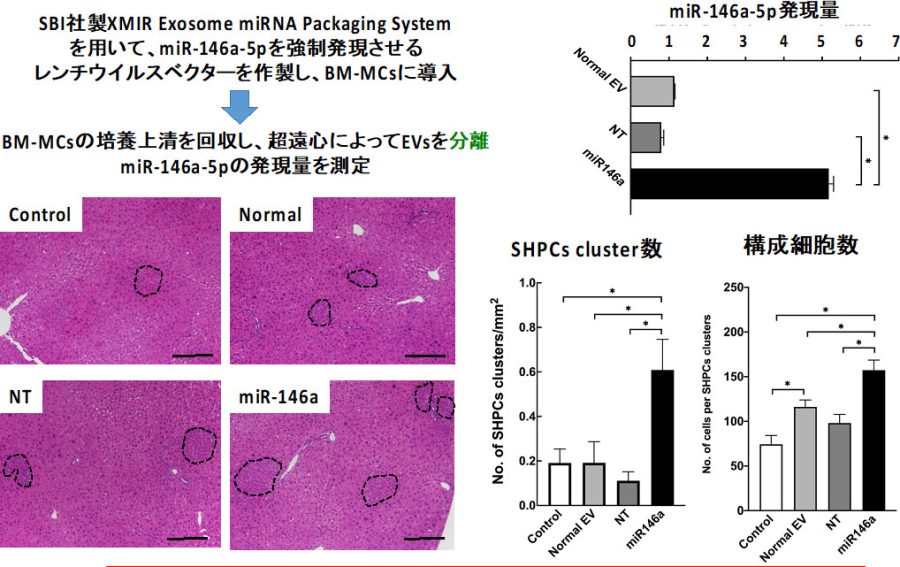
図22. miR146a-5pを強制発現したBM-MCsの分泌するEVs中に含まれるmiR-146a-5p量。EVs投与後、2週間目の肝臓に形成されたSHPC cluster数と構成細胞数を計測した。*p<0.05
miR-146a-5p含有量が5倍増えたEVsをRet/PHモデルラット肝臓に投与し、2週間目の肝臓に出現するSHPC clustersを計測した。miR-146a-5pを強制発現したBM-MCsの産生するEVsを投与した肝臓におけるSHPC cluster数は有意に増加し、Clusterも大きくなった。
BM-MCsを移植した肝臓に出現するSHPCsの遺伝子発現を網羅的に解析した。
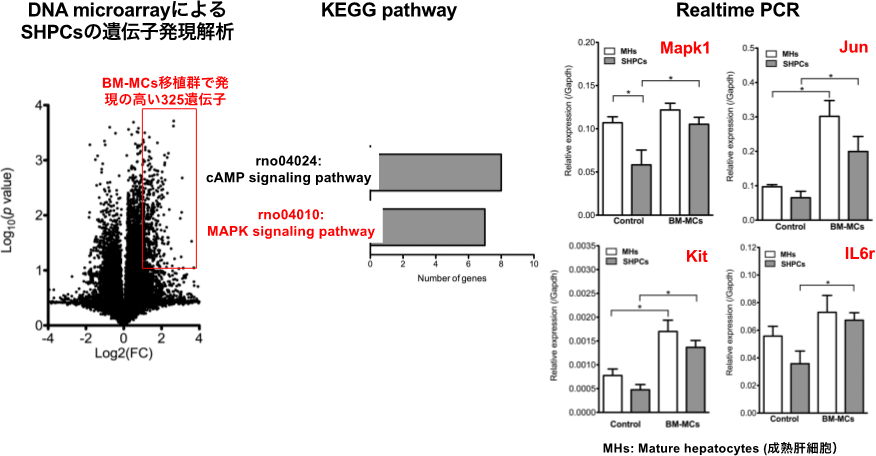
図23. SHPC clusterとその周囲のMHsにおける遺伝子発現。*p<0.05
BM-MCsを移植した肝臓では、SHPCsで発現の高い遺伝子群にMAPKシグナル関連遺伝子が多く含まれていた。Realtime-PCRにより発現を確認するとMHs及びSHPCsどちらの細胞でもJun, Kit, Il6r遺伝子の発現が上昇していた。この結果は、BM-MCs移植により、MHs及びSHPCsいずれの細胞にも増殖シグナルが入るが、Retrorsineにより細胞分裂が抑制されたMHsは増殖出来ずSHPCsのみが増殖したことを示している。
結果をまとめると、
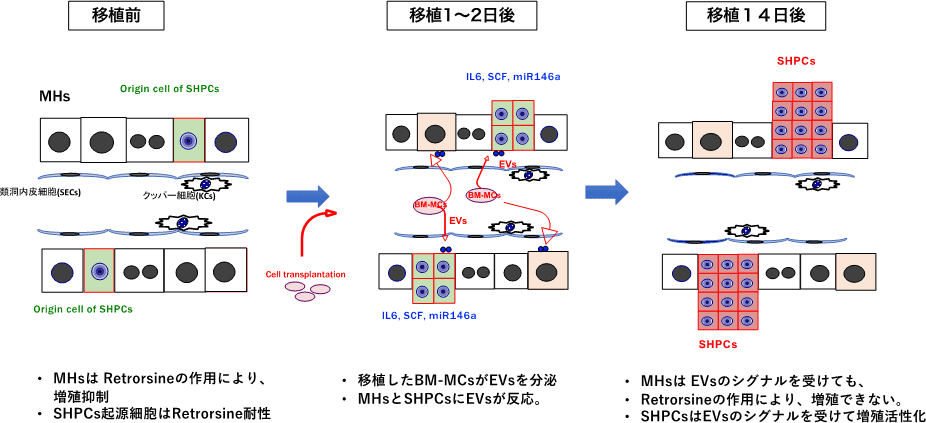
図24. BM-MCs移植による肝臓再生をイラストで示す。
障害肝由来及び骨髄由来Thy1陽性間葉系細胞は、Ret/PHモデルラット肝臓に移植すると、どちらも内在性肝前駆細胞であるSHPCsの増殖を促進した。ドナー細胞の大部分は肺や肝臓の貪食細胞に処理され、2,3日で肝臓内には認められなくなることから、ドナー細胞のSHPCs増殖促進作用は、一時的に肝臓内に滞留しているときに分泌するEVsによると考えられる。しかしながら、そのSHPCs増殖促進機序は、由来組織により異なった。障害肝由来Thy1陽性細胞の分泌するEVsは、類洞内皮細胞やSHPCsに取り込まれ、類洞内皮細胞ではIL17Bを、SHPCsではIL17RBの発現を促進した。クッパー細胞はドナー細胞を貪食することによりIL25を発現分泌し、類洞内皮細胞の分泌するIL17Bと共にSHPCsのIL17RBシグナルを活性化し増殖を促進する。クッパー細胞の貪食活性を抑制するとSHPCsの増殖促進効果が失われることから、IL25の作用が主体であると考えられる。一方、骨髄由来間葉系細胞の移植においては、ドナー細胞が分泌するEVsに含まれるmiR146a-5pにSHPCsの増殖促進効果を認めた。EVsに含まれるSCFやIL6もSHPCsの増殖促進効果を認めたがMHsに対しても同様に増殖促進作用があることから、miR146a-5pが増殖促進作用の主体であると考えられる。miR146a-5pの発現を高めた骨髄間葉系細胞が分泌するEVsを投与するとSHPCsの更なる増大を認めたこともその考えを支持する。ガドリニウムによるクッパー細胞の貪食抑制によるSHPCsの増大は、ドナー細胞の類洞内滞留する時間が増えたことにより近辺に存在するSHPCsへのEVsや増殖誘導サイトカインの曝露量が増大したことによると考えられる。
SHPC Clusterの増大は1ヶ月ほど続くが、その多くは細胞老化に陥り脱落し、移植後2ヶ月ほどすると、肝臓は元の大きさにもどることが分かっている。
解決すべき課題
- 障害肝由来Thy1陽性細胞も骨髄間葉系細胞も肝細胞へ分化可能な幹細胞を含んでいるが、内在性肝前駆細胞を増殖させる細胞分画の同定
- 類洞内皮細胞におけるIL17bやクッパー細胞におけるIL25発現誘導機序
- EVsのターゲット細胞に対する特異性
- Kon J, Ichinohe N, Ooe H, Chen Q, Sasaki K, Mitaka T. Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration. Am J Pathol, 175(6): 2362-2371 (2009) doi: 10.2353/ajpath.2009.080338
- Ichinohe N, Kon J, Sasaki K, Nakamura Y, Ooe H, Tanimizu N, Mitaka T. Growth ability and repopulation efficiency of transplanted hepatic stem, progenitor cells, and mature hepatocytes in retrorsine-treated rat livers. Cell Transplant, 21(1): 11-22 (2012) doi: 10.3727/09636
- Ichinohe N, et al. Transplantation of Thy1+ cells accelerates liver regeneration by enhancing the growth of small hepatocyte-like progenitor cells via IL17RB signaling. Stem Cells, Apr; 35(4): 920-931 (2017) doi: 10.1002/stem.2548
- Ichinohe N, Ishii M, Tanimizu N, Mizuguchi T, Yoshioka Y, Ochiya T, Suzuki H, Mitaka T. Extracellular vesicles containing miR-146a-5p secreted by transplanted bone marrow-derived mesenchymal cells activate hepatocytic progenitor cells in regenerating retrorsine-treated rat livers. Stem Cell Research & Therapy, May 29;12(1):312 (2021) doi: 10.1186/s13287-021-02387-6



