(1)オーバル細胞(Oval cells)
(1)-2 細胆管(CoH)から肝細胞への分化
オーバル細胞は、小型の(好塩基性)肝細胞を介して成熟肝細胞への分化することは確かであり、研究者間に異論はないと思われる。出現した細胆管なりオーバル細胞が全て肝細胞に分化しているとは考えにくいが、オーバル細胞が全て肝細胞へ分化するのか、一部の細胞だけが分化するのか、肝細胞以外には分化しないのか、未だ明確な答えは出ていない。その原因の一つに、これまでの実験系では、増生したオーバル細胞が両方の性質を持つ小型の肝細胞と接続している像を見つけるのが極めて難しかったことがある。
我々は、増生した細胆管(ヘリング管)から小型の肝細胞、成熟肝細胞への分化が明瞭にわかる実験系を確立した。
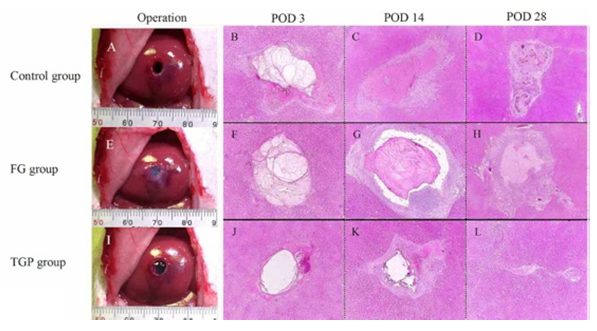
図1. 正常ラット肝臓に直径5mm程の穴を開け、その再生過程をみた。開放したまま(control)、fibrin gel (FG)または温度感受性ゲル(TGP)を充填したラットで比較した。
(Nagaya M et al, Hepatology, 2006)
ラット肝臓に円筒状にくり抜いた障害を作成し、その後の再生をみると、障害部を開放した状態では血栓を形成し、創傷治癒機転が起こり最終的に結合織で置き換わる。肝細胞が再生して置き換わることはない。しかしながら、温度感受性ゲルを用いてその障害部分を塞ぐと、一ヶ月ほどでほぼ治癒し、線維化はほとんど認めなくなる(図1)。
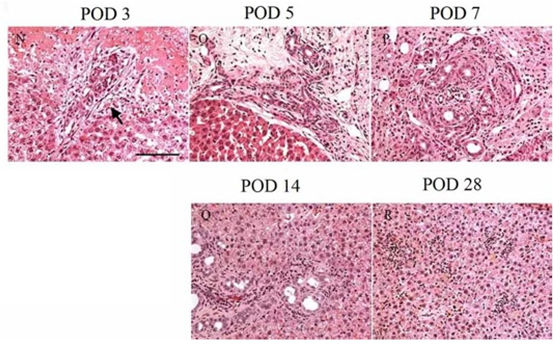
図2. 温度感受性ゲルを充填した肝組織のHE像。壊死した組織とゲルに向かって細胆管が増生していく。14日目では細胆管が減少し、小型の肝細胞に囲まれる。4週間後には障害部分は若干の炎症細胞浸潤を残してほぼ肝細胞に置き換わっている。
(Nagaya M et al, Hepatology, 2006)
この肝再生では、障害部に接する部分に炎症反応が起こり細胆管が増生する(図2 POD3)。障害後1週間程は細胆管の増生が続き、その後徐々に減少し小型の肝細胞に置き換わっていく様に見える(図2)。4週間後には、障害部はほぼ肝細胞に置き換わり再生が終了する。
充填したゲルは、徐々にマクロファージにより処理され最終的に障害部から除去される。約1ヶ月後の肝組織中にゲルは残存していない。
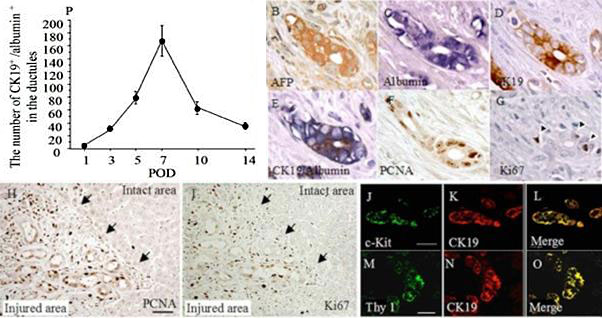
図3. 増生した細胆管の特徴。(B-I)連続切片を免疫染色している。(J-O)オーバル細胞のマーカーであるc-Kit及びThy1とCK19二重免疫染色。(P)細胆管を構成する細胞の内 albumin陽性/CK19陽性細胞の単位面積あたりの数。
(Nagaya M et al, Hepatology, 2006)
図3で示すように、増生した細胆管を構成する細胞は Albumin, CK19を持ち、AFP,c-Kit,Thy1陽性でオーバル細胞としての特徴も持っている。つまりオーバル細胞と肝細胞のどちらの性質も持つ中間型の細胞である。この形質を持つ細胞数は、障害後7日目が最大である(図3P)。またPCNA, Ki67陽性の核を持つことから増殖している。
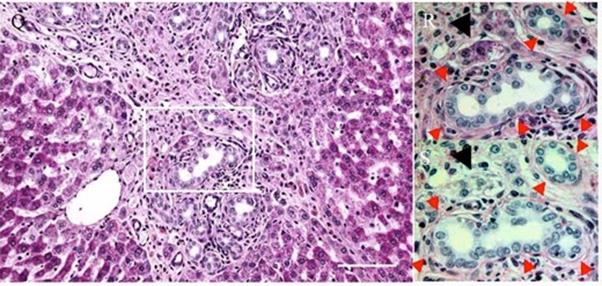
図4. 細胆管と接して出現する小型の肝細胞。障害後7日目のHE像及びPAS染色(R)と同部のジアスターゼ処理後(S)の写真。
(Nagaya M et al, Hepatology, 2006)
- 細胆管は基底膜(PAS陽性)に囲まれている。その周囲に見られるPAS陽性の細胞質を持つ小型の細胞(図4R、黒矢印)はジアスターゼ処理(図4S)により染色性を失うことからグリコーゲンを有している肝細胞と考えられる。
- 障害後7日目ごろより増生する細胆管周囲に出現する小型細胞は、細胆管細胞(オーバル細胞)が中間型の性質を持つ細胞に分化し、その後さらに小型肝細胞に分化したものと考えられる。
- Nagaya M, Kubota S, Suzuki N, Akashi K, Mitaka T. Thermoreversible gelation polymer induces the emergence of hepatic stem cells in the partially injured rat liver. Hepatology, 43(5), 1053-1062 (2006)



