肝臓の再生 (Liver Regeneration)
肝臓が再生することは、ギリシア神話に登場するプロメテウスを例に出してよく紹介される。プロメテウスは、人間に「火」を与えた罪で、コーカサスの山頂で生きながらにして毎日肝臓を大鷲についばまれる責め苦を強いられる。不死のプロメテウスの肝臓は夜中に再生し、ヘラクレスにより解放されるまで半永久的に責め苦が続く、と云うお話しである。それほど昔から知られていた現象であるが、科学的に証明したのはHiggins GM & Anderson RMが1931年Archives of Pathologyに報告したのが最初である。ラットの肝臓は大小6つの葉(lobe)からできているが、その大きな葉2つで全体の約2/3の体積を占める。その2つの葉を根本で結紮切除する2/3部分肝切除(partial hepatectomy; PH)を行うことができる。正常ラット・マウスを用いると約1週間でほぼ元の大きさ(重さ)に戻る。切り取った葉が新たにできるわけではなく、残った4つの葉が大きくなるので正確には代償性肥大(compensatory hypertrophy)である。しかしながら、肝臓はどこをとってもほぼ一様な組織であるので、切除した組織と同等な組織が、消失した分増えていることやヒトや豚など分葉していない肝臓においても同様に再生することからラットにおいても代償性肥大といわず再生としている。
肝臓の再生と云えば、この部分切除後の再生を指すことが多いが、成体肝臓における再生には、その主体となる細胞により大きく分けて3つの機序がある。
(1)多数の肝細胞の消失が急速に起こった場合である。物理的に切除された場合や四塩化炭素(CCl4)など肝細胞毒による肝細胞壊死による消失後の再生がこれに相当する。この場合、成熟肝細胞の増殖により消失分は補塡されるため、肝細胞主体の再生といえる(hepatocyte-mediated regeneration)。
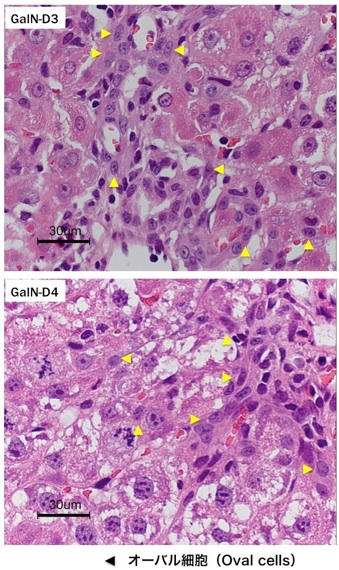
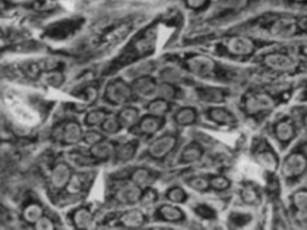
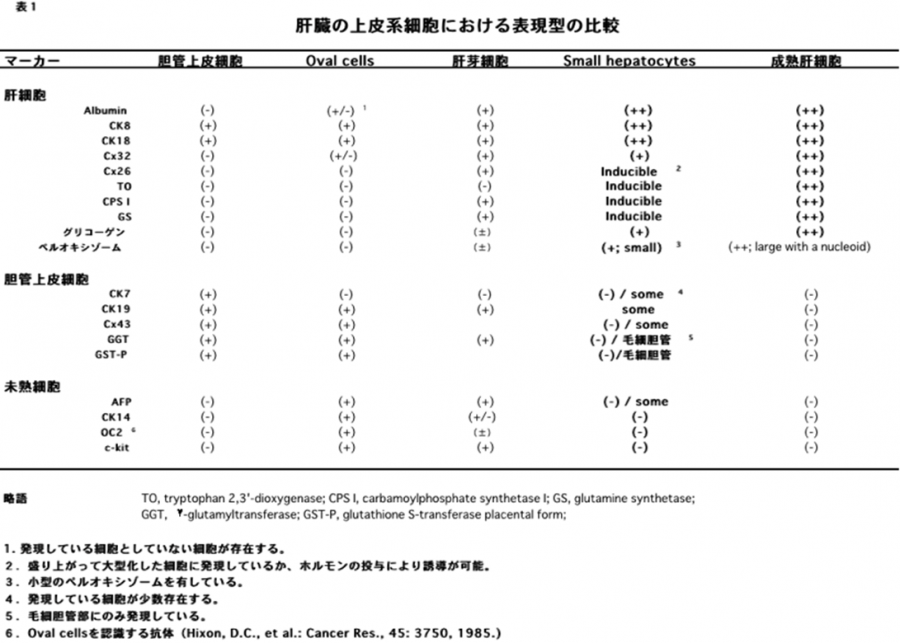
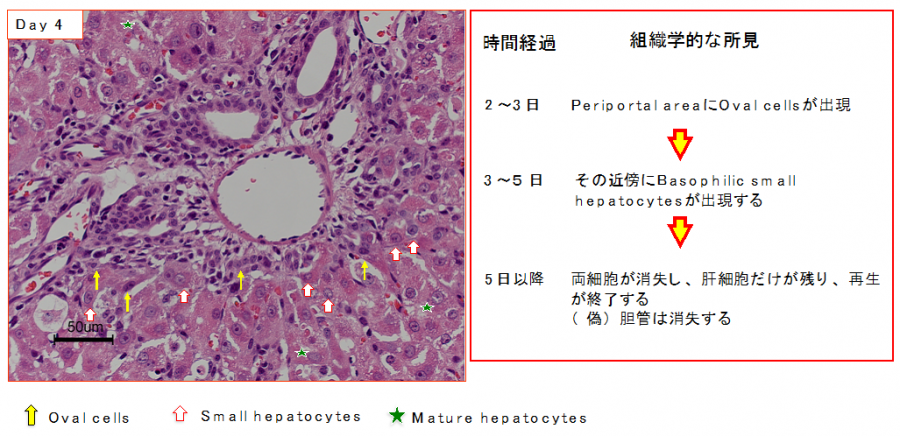
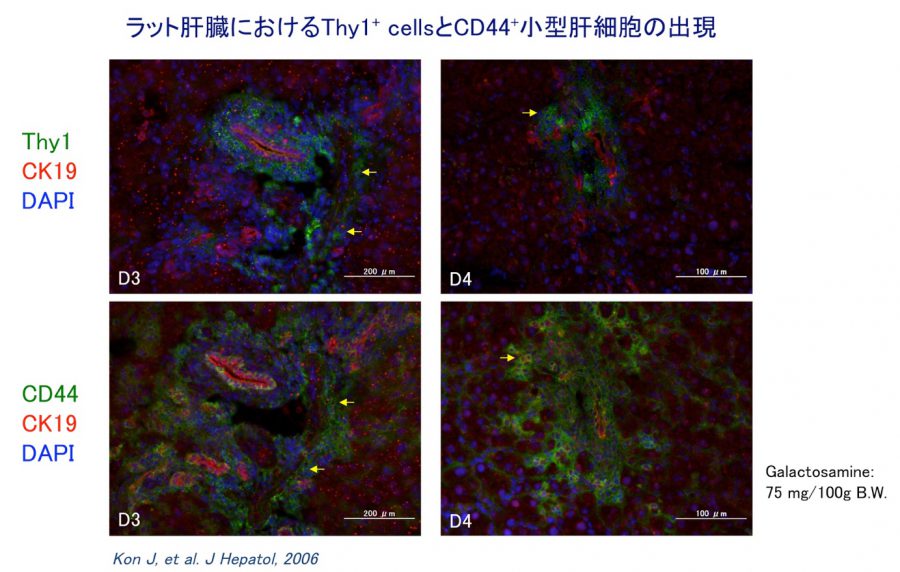
(2)肝細胞の増殖が抑制された状態で多数の肝細胞消失が起こった場合である。2-アセチルアミノフルオレン(2-acetylaminofluorene; 2-AAF)のような発癌剤を投与したラットに部分肝切除やCCl4を投与した場合やガラクトサミン投与、 エチオニン添加コリン欠乏食投与、3,5-diethoxycarbonyl-1,4-dihydro-collidine (DDC)後の肝再生がこれに相当する。後者の場合、オーバル細胞(Oval cells)と呼ばれる、小型で楕円形の核を持つ細胞がグリソン鞘(Glisson’s sheath)から細胆管(bile ductules)に類似した管腔構造を呈し、小葉内に向かって増生する。残存肝細胞とオーバル細胞の境界部分には、好塩基性の細胞質を持つ小型な肝細胞が出現し、オーバル細胞の消退と入れ替わるように肝細胞に置き換わっていく。このような再生は、幹・前駆細胞が主体となる肝再生と云える(stem/progenitor cell-mediated regeneration)。
- *最近の研究により、このような場合も胆管周囲や中心静脈周囲に存在する肝細胞が再生を担っていることが報告されるようになり、幹細胞主体の再生か否か議論がある。
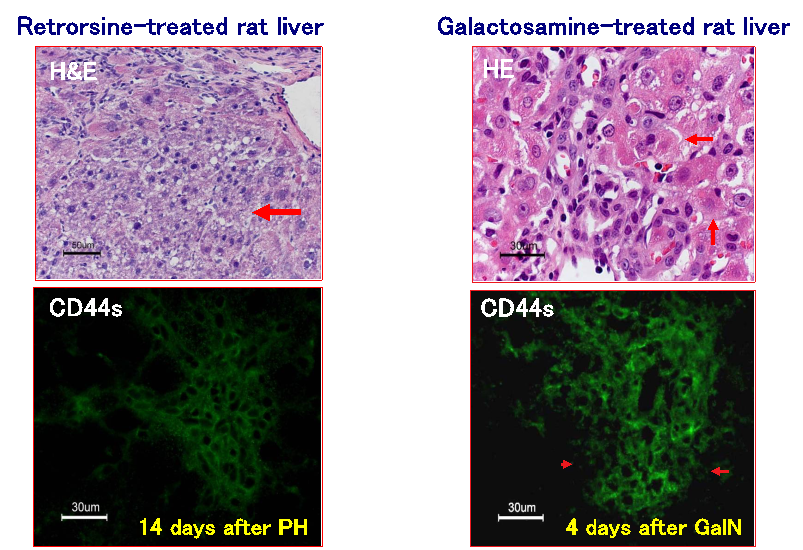
(3)アルカロイドの一種であるRetrorsineを投与し肝細胞の分裂を抑制した状態で部分肝切除や四塩化炭素投与を行った場合である。内在性の小型肝細胞様前駆細胞(small hepatocyte-like progenitor cells; SHPCs)の増殖巣が多数出現し、一ヶ月ほど立つと周囲の肝細胞と見分けのつかない様になり、肝臓は再生する。
成体動物肝臓において形態学的に確認されている肝幹・前駆細胞はオーバル細胞と小型肝細胞の2種のみで、報告されている他の細胞は表面抗原をターゲットにFACSなどを用いて肝臓組織から分離した細胞で、その頻度は極めて低くまた肝臓常在の細胞か否かはっきりしないことが多い。
ヒト肝疾患においても動物に見られるような肝再生がみられる。生体肝移植は、肝臓の持つ旺盛な肝再生能力を利用した代表的な治療法である。正常な肝臓を50〜70%切除してレシピエントの病的肝臓と交換するのであるから、ドナーもレシピエントの肝臓どちらも再生しないと成り立たない治療法である。外科手術後の肝再生の機序については、多くの研究がなされ大方解明されている。実験ラット肝臓ではオーバル細胞(Oval cells)をよく認めるがヒト肝疾患では稀である。よく見られるのは細胆管反応(ductular reaction)と呼ばれる細い胆管の増生像であり、胆管疾患に伴ってみられることが多い。
日本における肝疾患の多くは肝炎ウイルスに起因する。B型、C型肝炎による慢性肝炎と肝硬変症、肝癌である。B型ウイルス感染により劇症肝炎(大部分の肝細胞が感染・壊死する状態)を発症することはあるが、多くは比較的少数の肝細胞が徐々に感染・壊死する病態になり慢性化する。感染初期は、失われた肝細胞の補塡は近隣の肝細胞の分裂により行われるが、何度も分裂が起こると次第に分裂能力を失い、埋められなくなった隙間に活性化星細胞が浸入し、分泌したコラーゲン線維がその隙間を埋めていく、いわゆる線維化が起こる。皮膚でみられる創傷治癒と同じ過程がこの時期に起こる。これが慢性肝炎の後期にみられる肝線維化であり、肝硬変症の始まりである。線維化が始まる前の時期に小型の肝細胞の集団がよく認められる。小型の肝細胞からなる再生結節は肝硬変ではよく見られる。そのような小型の肝細胞は、成熟肝細胞が増殖できない状態が生じた時に、肝細胞の中に紛れていた増殖能の高い前駆細胞(progenitor cell)が 姿を現したものと我々は考えている。
我々の見出した小型肝細胞(small hepatocyte)と、ヒト肝臓で見られる小型の肝細胞とは同じ由来ではないかと考え、この小型肝細胞について研究することで肝再生医療、創薬研究、人工肝臓作製の早期実現に繋げたいと考えている。
これまでの研究成果は、下記の項目を参照して欲しい。