(2)小型肝細胞
(2)-4 肝細胞機能
肝臓は、生体内の化学工場と呼ばれるほど様々な働きをしている。その機能の多くは肝細胞が担っている。代表的な機能には次のようなものがある。
(A) 代謝機能 <糖・脂質・タンパク質・アルコール代謝など>
(B) 血清タンパク質の産生
(C) 薬物代謝・解毒
(D) 胆汁の産生と排泄
肝臓からコラゲナーゼ(collagenase)を用いて分離した肝細胞を初代培養肝細胞(primary hepatocytes)と呼ぶ。分離直後の肝細胞は、肝細胞としての機能をほぼ全て有しているが時間と共に急速にその機能は失われる。肝細胞は接着性の上皮細胞であるので、培養皿などに接着出来ないとアノイキス(anoikis)を起こし死ぬ。培養皿に播種し培養を行っても、通常の培養液(10%牛血清、インスリン、デキサメタゾン等の添加)で培養すると、数日の内に主要な機能は測定検出以下になる。最後まで残るのがアルブミン産生でこの機能は肝細胞が死ぬまで持っている。一方、初代培養肝細胞機能として最も重要視されるのが薬物代謝に関係するチトクロームP450(CYP)活性であるが、その活性は急速に低下し、これまでの培養方法では培養2日目には遺伝子発現すら検出できなくなる。
肝前駆細胞であることを示すためには、肝細胞に分化することを示す必要がある。そのためには、肝細胞であることをどのように証明するか、つまりどのような機能(マーカー)を示すようになれば肝細胞と云えるのか、を決めておくことが重要である。生体内において肝細胞が果たしている主な機能は、上記(A)~(D)である。
遺伝子発現の有無で分化したかどうかを判断するのは、網羅的な解析でパターンを示す場合を除いては不十分だと考えている。実際の機能を担うのはタンパク質であるからその発現を免疫染色法やWestern blot法で示すのが好ましく、活性を測定するのがより好ましい。
培養細胞が肝細胞機能を持つことを示すためによく用いられている代表的なマーカーを示すと次のようなものとなる。
(A)代謝機能
- 糖代謝
- Glucose-6-phosphatase (G6Pase; 活性染色)
Glycogen (PAS染色+diastase消化) - アミノ酸代謝
- Tyrosine aminotransferase (TAT)
Tryptophan 2,3-dioxygenase (TDO or TO) - 窒素代謝
- Carbamoylphosphate synthetase (CPS)
Glutamine synthetase (GS)
(B)血清タンパク質産生
Albumin
Transferrin
血液凝固因子;plasminogen, prothrombin
α-fetoprotein (AFP) <未熟性を示す>
(C)薬物代謝・解毒
- 薬物代謝酵素
- チトクロームP450 (Cytochrome P450, CYP)
Glutathione S-transferase (GST) - アンモニア代謝
- Ammonia代謝試験
Urea synthesis(尿素合成)
(D)胆汁の産生と排出
Bilirubin代謝
胆汁酸の産生と排泄
ラット小型肝細胞の肝細胞機能関連遺伝子の発現をGeneChip(Agilent)を用いて調べた。
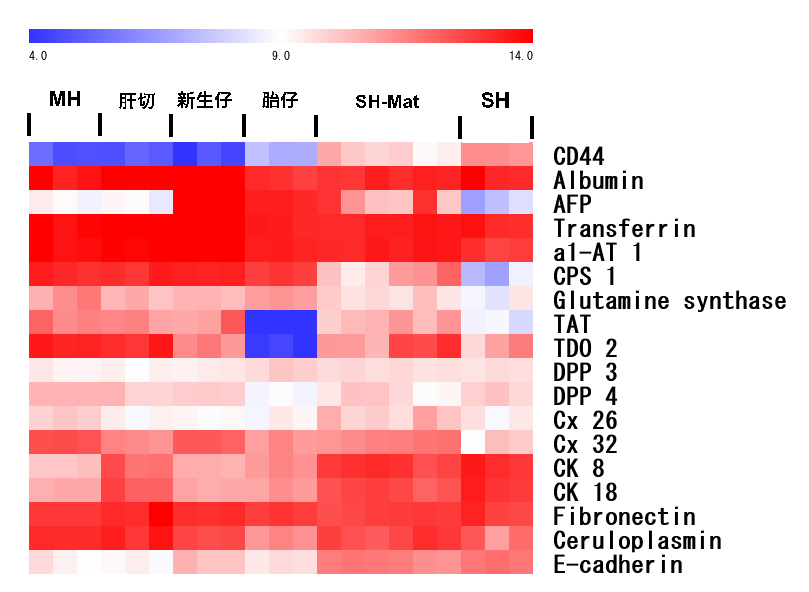
図1. 正常ラット肝臓から分離し培養した小型肝細胞(10日目;SH)とMatrigelにより成熟化誘導を行った小型肝細胞(SH-Mat)の遺伝子発現をGeneChip (Affymetrix)を用いて検討した。成熟肝細胞(MH)と胎仔肝臓(E20; HB)をコントロールとした。
成熟肝細胞と比べるとCPS, GS, TAT, TDO, Ceruloplasminなどの発現は低めだが、albumin, transferrin, antitrypsinなどの発現はほとんど変わらないことがわかる。
(Ooe H et al. Drug Metab Disposit, 2006)

図2. 正常ラット肝臓から分離し培養した小型肝細胞(10日目;SH)とMatrigelにより成熟化誘導を行った小型肝細胞(SH-Mat)の遺伝子発現を網羅的に解析した。
小型肝細胞は、成熟肝細胞より低いが肝細胞機能に関する遺伝子を発現している。Matrigelにより成熟化誘導を行った小型肝細胞は、新生仔程度の肝細胞機能を持つことが分かる。

図3. Matrigel投与により成熟化した小型肝細胞の代表的CYPタンパク質の薬剤誘導性。
(Miyamoto S et al. J Gastroenterol Hepatol, 2005)
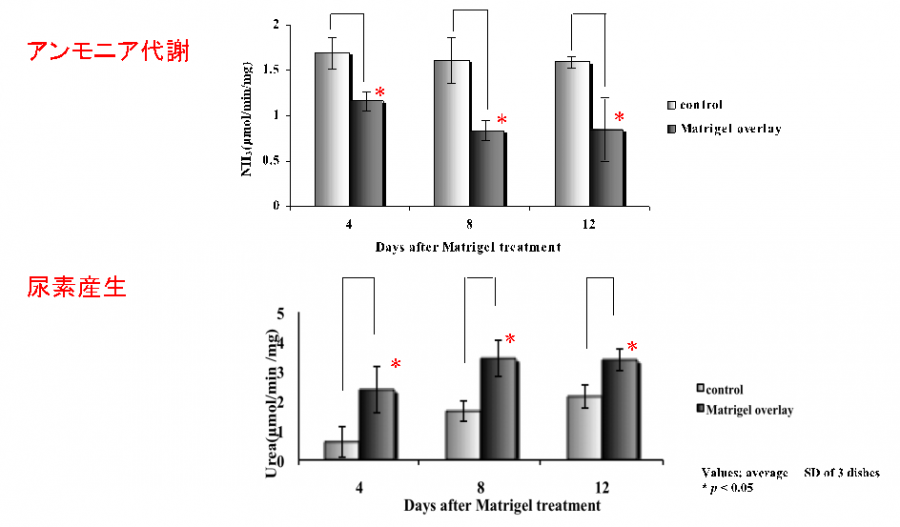
図4. Matrigelにより成熟化誘導された小型肝細胞は、アンモニア代謝能及び尿素合成能を有している。
血液中のビリルビンは、類洞面に局在するTransporterのOatp1を介して肝細胞内に取り込まれ、グルクロン酸抱合された後、毛細胆管面に局在するTransporterのMrp2を介して毛細胆管に排泄される。
下図は、培養液中にビリルビンを加えた時に、代謝産物が毛細胆管に排泄されるかみることにより、小型肝細胞が成熟化し、毛細胆管を形成しているか検討した結果である。
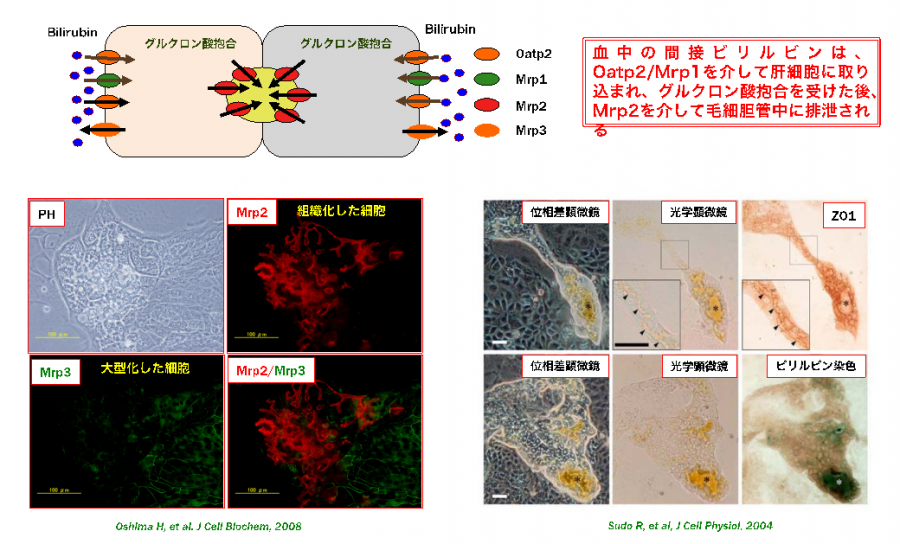
図5. 成熟化し組織化した小型肝細胞コロニーでは、毛細胆管網が発達し、嚢胞状の構造も形成される。毛細胆管面にはビリルビンの排出を担うトランスポーターのMRP2が発現し、グルクロン酸抱合を受けたビリルビンは毛細胆管内に排泄され、一方向に輸送され嚢胞状構造に蓄積する。組織化していない小型肝細胞にはMRP3が発現しており、取り込まれたビリルビンは培養液中に分泌される。
(Oshima H et al. J Cell Biochem, 2008)
- l Mitaka T, Sato F, Mizuguchi T, Yokono T, Mochizuki Y. Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology, 29(1), 111-125 (1999)
- Mitaka T, Sato F, Ikeda S, Sugimoto S, Higaki N, Hirata K, Lamers WH, Mochizuki Y. Expression of carbamoylphosphate synthetase I and glutamine synthetase in hepatic organoids reconstructed by rat small hepatocytes and hepatic nonparenchymal cells. Cell Tissue Res, 306, 467-471 (2001)
- Sugimoto S, Mitaka T, Ikeda S, Harada K, Ikai I, Yamaoka Y, Mochizuki Y. Morphological changes induced by extracellular matrix are correlated with maturation of rat small hepatocytes. J. Cell. Biochem.. 87(1), 16-28 (2002)
- Ooe H, Kon J, Miyamoto S, Oozone Y, Ninomiya S, Mitaka T. Cytochrome P450 expressions of cultured rat small hepatocytes after long-term cryopreservation. Drug Metab Disposit, 34(10), 1667-1671 (2006)
- Sudo R, Ikeda S, Sugimoto S, Harada K, Hirata K, Tanishita K, Mochizuki Y, Mitaka T. Bile canalicular formation in hepatic organoid reconstructed by rat small hepatocytes and nonparenchymal cells. J Cell Physiol, 199(2), 252-261 (2004)
- Miyamoto S, Hirata K, Sugimoto S, Harada K, Mitaka T. Expression of cytochrome P450 enzymes in hepatic organoid reconstructed by rat small hepatocytes. J. Gastroenterol. Hepatol., 20(6), 865-872 (2005)
- Oshima H, Kon J, Ooe H, Hirata K, Mitaka T. Functional Expression of Organic Anion Transporters in Hepatic Organoids Reconstructed by Rat Small Hepatocytes. J Cell Biochem, 104(1), 68-81 (2008)



