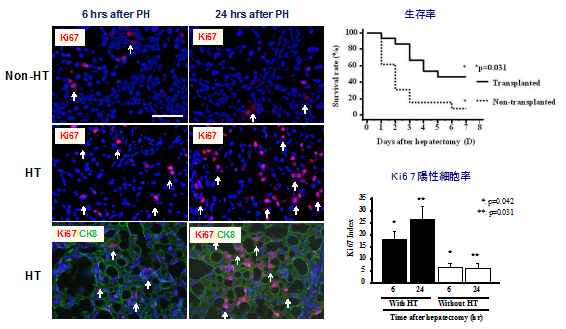
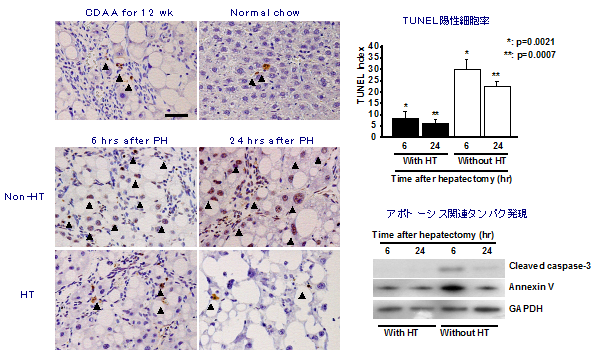
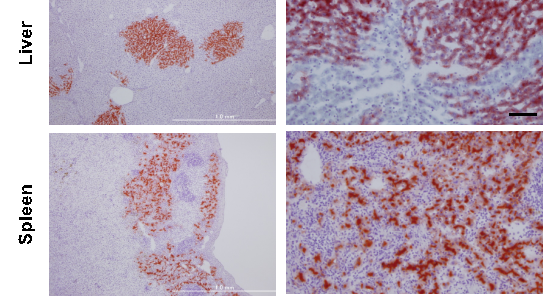
細胞移植による肝細胞置換
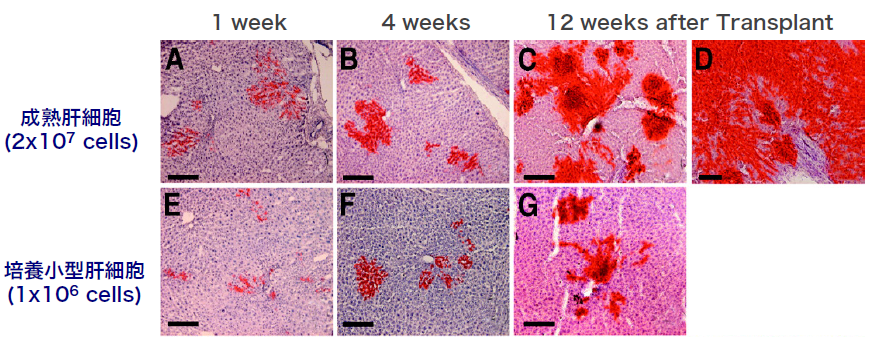
肝幹・前駆細胞は、旺盛な増殖能力やin vitroで肝細胞への分化能を持つことなどから、肝移植に代わる肝細胞移植の細胞ソースとして期待されている。しかしながら、ラットなどを用いた移植実験では、ドナー細胞として幹・前駆細胞を用いた場合のレシピエント肝臓への生着率は、成熟肝細胞を用いた場合と比較して低いことが知られている。
また正常ラット肝臓に細胞移植を行っても生着しないことが知られている。同系ラット由来の細胞であっても生着できないので免疫拒絶が起こっているわけではない。現在の所、ドナー細胞が生着し既存肝細胞と置換するためには、レシピエント肝臓の環境が重要であることが分かってきた。
ドナー細胞が生着し置換するために求められるレシピエント肝臓の環境

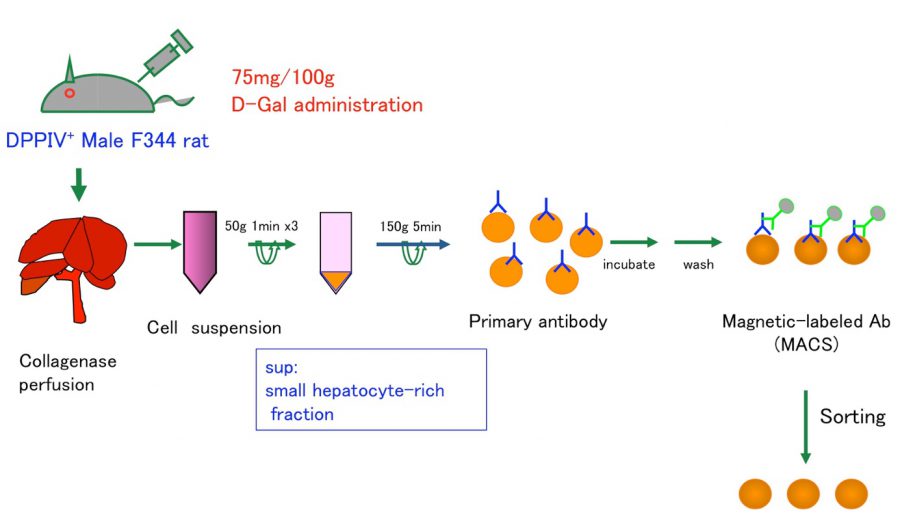
我々は、ドナー細胞として肝幹細胞、前駆細胞および肝細胞を用いて移植実験を行い、レシピエント肝に生着したそれぞれの細胞の分化や増殖を経時的に解析することにより、肝細胞移植に最適な幹・前駆細胞の同定や移植条件の最適化などを目指している。
- Shibata C, Mizuguchi T, Kikkawa Y, Nobuoka T, Oshima H, Kawasaki H, Kawamoto M, Katsuramaki, T, Mitaka T, Hirata K. Liver repopulation and long-term function of rat small hepatocyte transplantation as an alternative cell source for hepatocyte transplantation. Liver Transplantation, 12(1), 78-87 (2006)
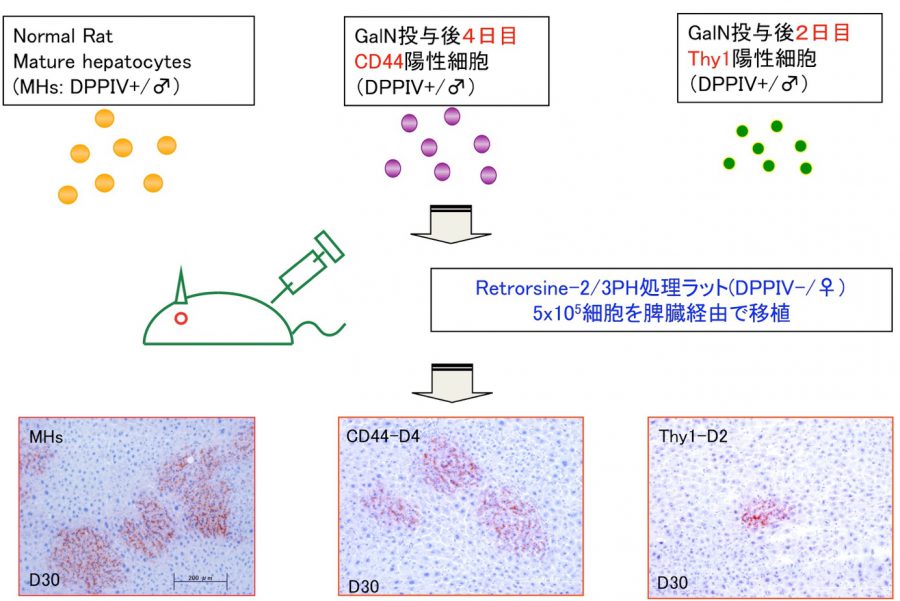
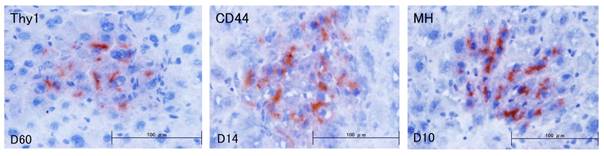
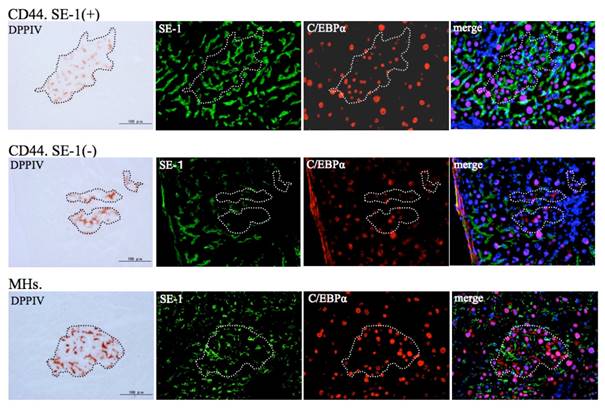
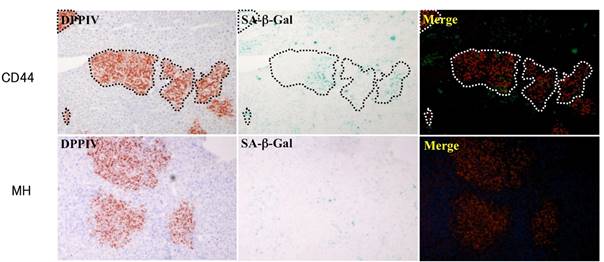
- Kon J, Ichinohe N, Ooe H, Chen Q, Sasaki K, Mitaka T. Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration. Am J Pathol, 175(6): 2362-2371 (2009)
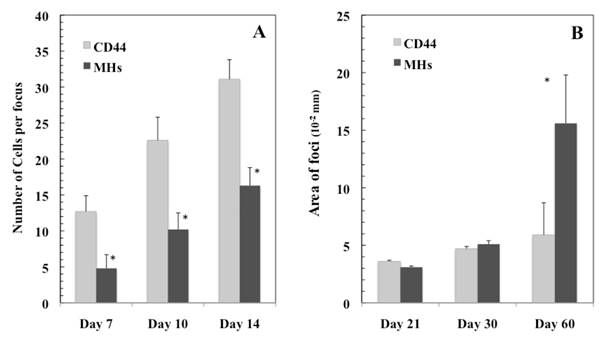
- Ichinohe N, Kon J, Sasaki K, Nakamura Y, Ooe H, Tanimizu N, Mitaka T. Growth ability and repopulation efficiency of transplanted hepatic stem, progenitor cells, and mature hepatocytes in retrorsine-treated rat livers. Cell Transplant, 21(1): 11-22 (2012)
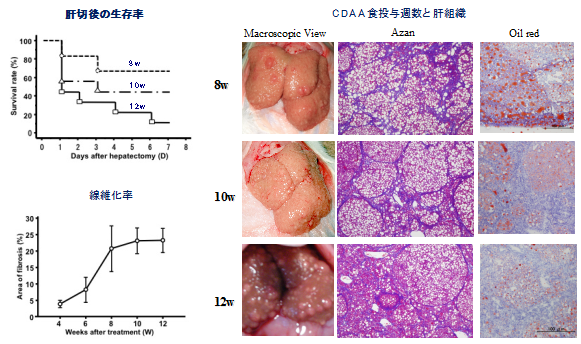
- Nakamura Y, Mizuguchi T*, Tanimizu N, Ooe H, Ichinohe N, Hirata K, Mitaka T. Preoperative hepatocyte transplantation prevents cirrhotic rats from receiving the fatal damage by a liver resection. Cell Transplantation, 23(10): 1243-1254 (2014)