(3)スキャフォールド(Scaffold)を利用した肝組織形成
こちらに文章や図表を入力します。自由にお試しください。
こちらに文章や図表を入力します。自由にお試しください。
成熟ラット肝臓より分離した肝細胞をラット尾より抽出したコラーゲンに浸した紙(Kimwipe)に播種し、培養すると培養皿に比較し、長期間アルブミン分泌能を維持することができた。紙の繊維間の隙間の大きさが適度で肝細胞が多層化し、立体構造を維持できていることが機能維持に寄与していると考えられる。
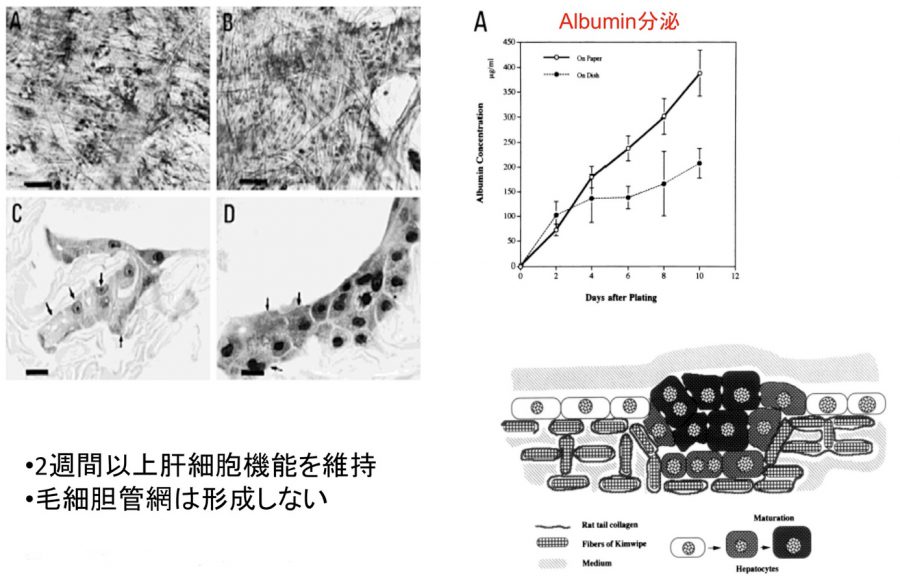
図1. 紙の中に形成された肝細胞組織。アルブミン分泌をELISA法で測定した。右下図は紙線維と肝細胞の配置模式図。
正常ラット肝臓から分離した小型肝細胞分画の細胞をコラーゲンスポンジ(Helistat®)上に播種し、培養した。培養経過に伴い小型肝細胞は増殖し、左図の様に肉眼的な大きさの組織塊を作ることができる。Fluorescent diacetate(FD)を代謝し、毛細胆管にfluorescenceを分泌していることから、成熟化した肝細胞からなる組織であることがわかる。
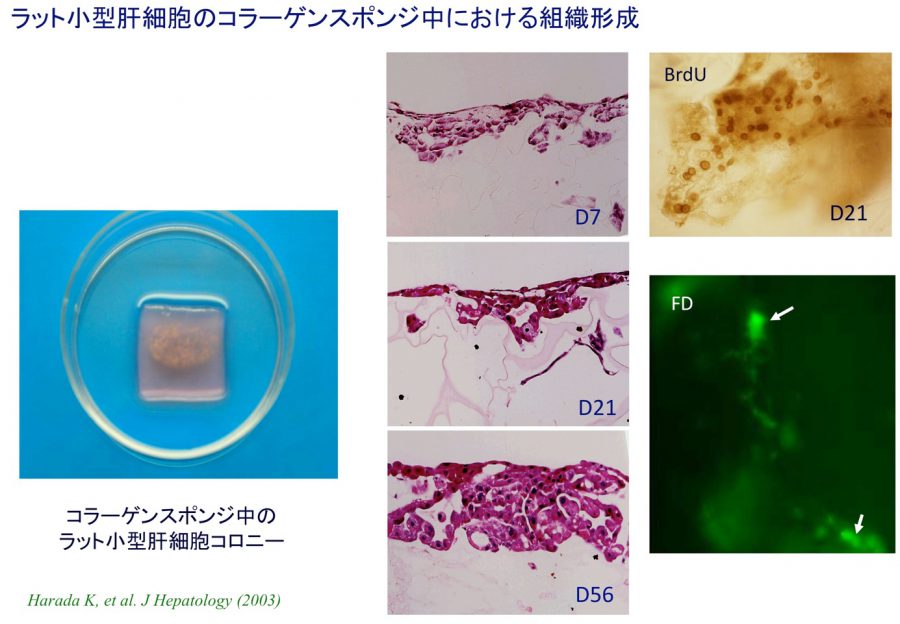
図1. ラット小型肝細胞画分の細胞をコラーゲンスポンジ上で培養した。培養経過に伴いスポンジ内部の空間を埋めるように増殖しているのが分かる。毛細胆管が組織内に形成され、投与したFDは、分解されたFluorescenceが毛細胆管に分泌され、一部嚢胞状になった部分に蓄積する。
(Harada K et al, J Hepatol, 2003)
外科手術で切除したヒト肝臓の正常部分の一部から細胞を分離し、小型肝細胞画分の細胞と胆管上皮細胞を含む画分を等量混合してコラーゲンスポンジ(Helistat®)上に播種し、培養した。約1ヶ月培養すると一部肝組織様構造を呈する組織塊が認められる。
成熟肝細胞(Hep陽性細胞)と胆管上皮細胞(CK19陽性細胞)からなる管腔構造、毛細血管様構造が形成されている。1ヶ月培養時点でも肝細胞、胆管上皮細胞とも増殖活性が高い(PCNA陽性核)。
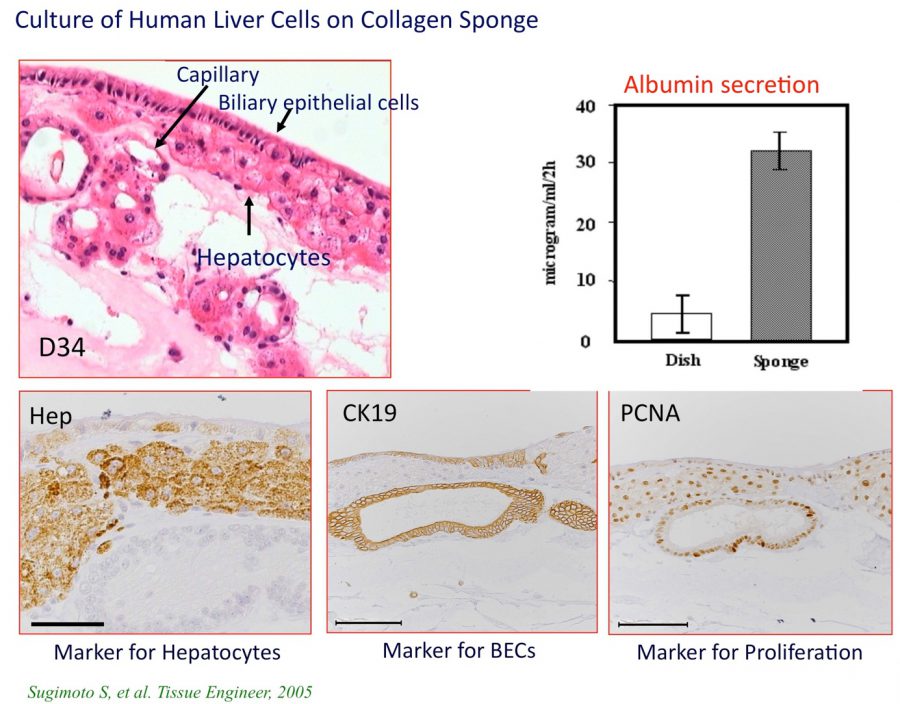
図2. ヒト肝組織から小型肝細胞分画と胆管上皮細胞画分を分離し、コラーゲンスポンジ上で培養した。培養液は小型肝細胞培養用を使用している。CK19陽性胆管上皮細胞はスポンジ表面上では培養液面には微絨毛が発達し、核は細胞下部に整列している。内部では、管腔形成が認められ、内腔側がApical面となっている。胆管上皮細胞直下に肝細胞が集塊となって存在し、増殖を続けている。培養一ヶ月後でも高いアルブミン産生能を維持している。
(Sugimoto S et al. Tissue Engineer, 2005)
成熟肝細胞のみで培養すると、培養皿上で培養するより長期間分化能を維持することができるが、小型肝細胞を用いた場合のように組織構築することはない。ヒト肝組織由来の細胞を混合培養することで胆管を組み込んだ肝組織を形成できることを示唆した研究である。
(慶應大学理工学部 谷下一夫名誉教授・須藤亮准教授との共同研究)
ポリカーボネート(polycarbonate)製の多孔性薄膜上で小型肝細胞を培養し、コロニーが形成され拡大したときに、2枚の薄膜を小型肝細胞同士が接触するように重層化し、人工的に3次元構造を作成する。小型肝細胞は成熟化し、対面の小型肝細胞間に毛細胆管が形成される。組織形成に伴いアルブミン分泌は増加し、成熟化していく。一方、成熟肝細胞(Primary hepatocytes)を同様に培養し重層するとアルブミン分泌は徐々に減少する。
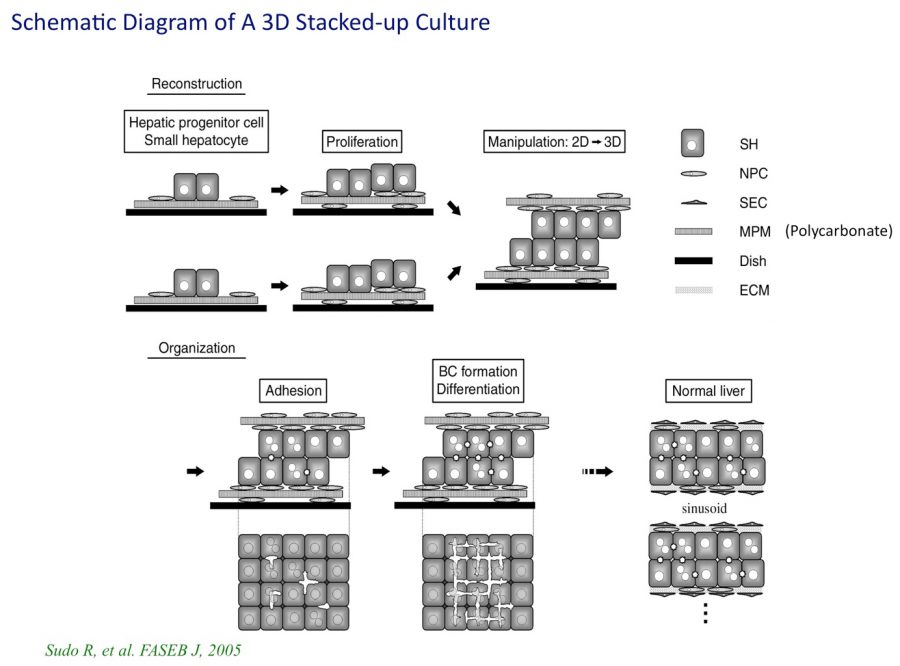
図1. 重層化した小型肝細胞による肝組織形成の模式図。ポリカーボネート(Polycarbonate)膜上でラット小型肝細胞を培養する。コロニーが形成された培養2週間目頃に2枚の膜を細胞が対面するように重層し、培養を継続する。重層した小型肝細胞は成熟化し、接着面に毛細胆管を形成する。
(Sudo R, et al. FASEB J, 2005)
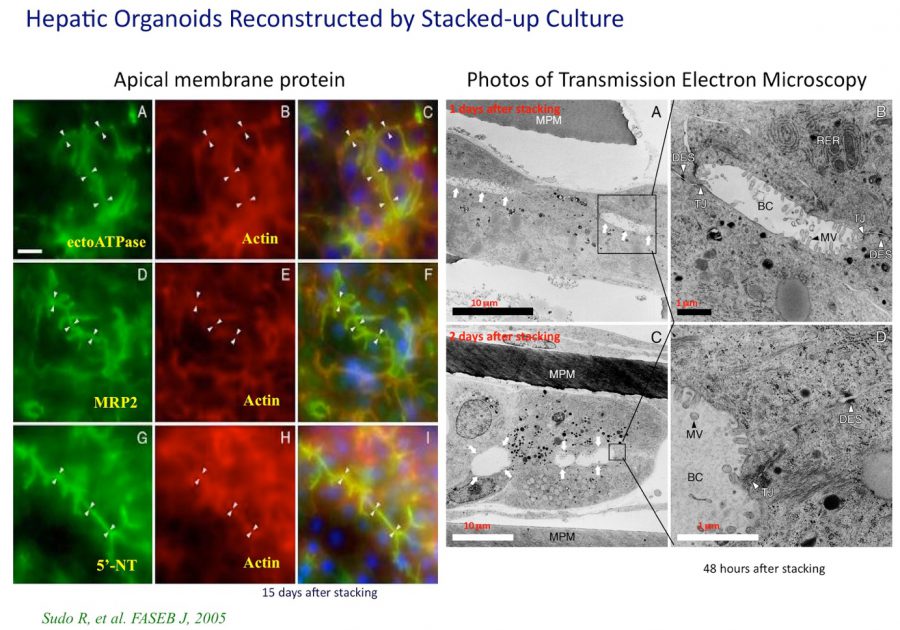
図2. 小型肝細胞の接着面に形成された毛細胆管網。毛細胆管面に発現することが知られているタンパク質の蛍光染色像。EctoATPase, Multidrug-related protein 2, 5’-Nucleotidaseとactinの2重染色。右は、透過電子顕微鏡写真。
(Sudo R, et al. FASEB J, 2005)
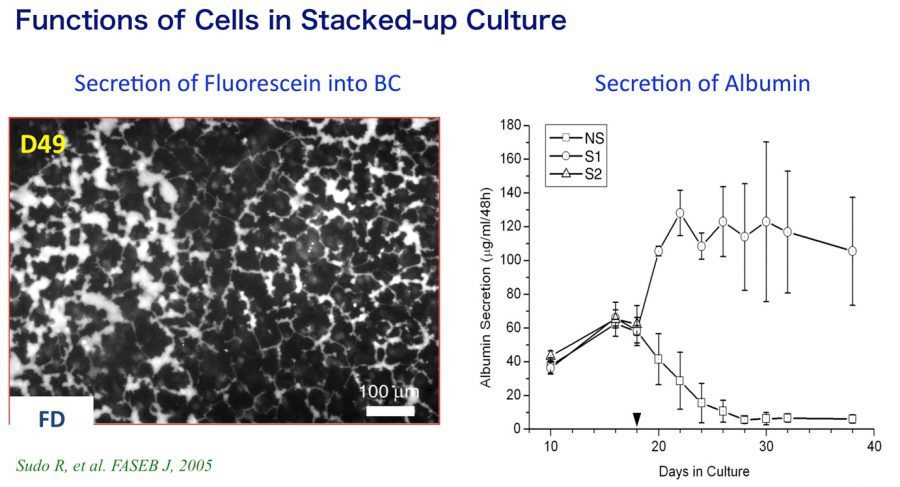
図3. Fluorescein diacetate (FD)を投与すると、肝細胞に代謝され毛細胆管に分泌されたFluoresceinによって接着面に形成された毛細胆管網が明瞭になる。
(Sudo R, et al. FASEB J, 2005)
肝類洞は、師板(fenestration)を持つ類洞内皮細胞からなる毛細血管の外側にディッセ腔(Space of Disse)を介して肝細胞が配列する特殊な構造を呈する。血流路側にクッパー細胞(Kupffer cell)、ディッセ腔内に星細胞(Stellate cell)が局在する。この構造をin vitroで再現することを目指した。成熟ラット肝臓から分離した小型肝細胞画分には小型肝細胞と非実質細胞である星細胞とクッパー細胞が含まれている。小型肝細胞は自己組織化能力があり、星細胞との相互作用により成熟化・組織化することが分かっている(Mitaka T et al, Hepatology, 1999)。類洞内皮細胞も分離当初は存在しているが、培養後数日で消失するため、代わりにウシ血管内皮細胞を用いて類洞のin vitro再構成を目指した。
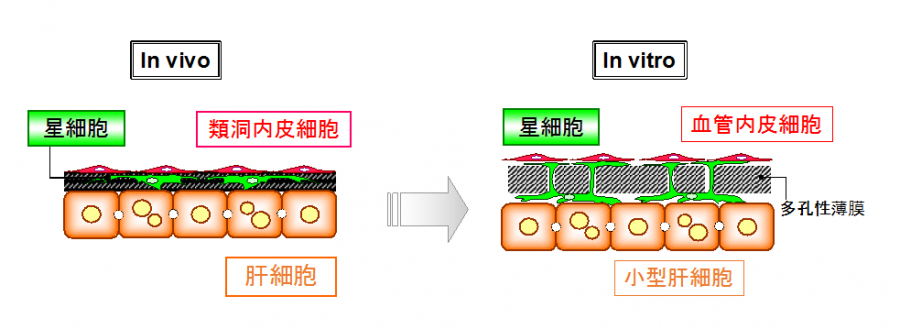
図1. 多孔性薄膜としてcell culture insertを用い、小型肝細胞画分の細胞を底面に培養し、2週間後に血管内皮細胞を上面に播種し培養する。
(Kasuya J et al, Tissue Eng A, 2011)
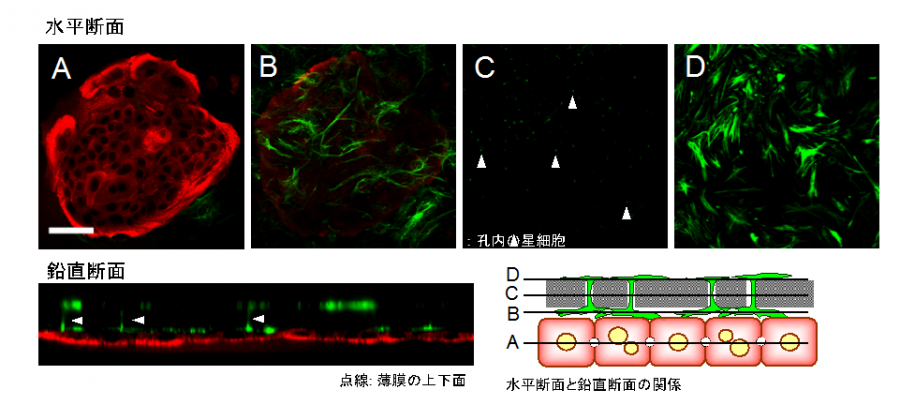
図2. 血管内皮細胞を播種する前の培養細胞の免疫染色像(赤:CK8, 緑:desmin)。CK8陽性小型肝細胞と薄膜に挟まれてdesmin陽性星細胞が局在する。薄膜の孔(径1.0 mm)を通って星細胞の細胞突起が薄膜表層に広がっている。
(Kasuya J et al, Tissue Eng A, 2011)
星細胞本体が通らない細胞突起のみが通るサイズの孔で隔離すると血管内皮細胞はよく接着する。星細胞は活性化されず静止状態でよく細胞外基質を分泌し、星細胞と血管内皮細胞間には基底膜成分がよく分布している。共培養状態では血管内皮細胞は敷石状では無く、紡錘型に配置する傾向を示す。
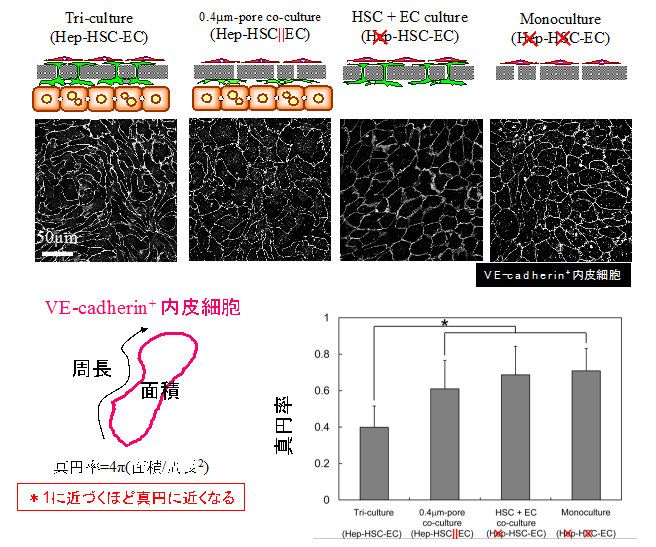
図3. 共培養による血管内皮細胞の形態変化
(Kasuya J et al, Tissue Eng A, 2011)
血管内皮細胞は、Matrigelで被覆すると血管様構造を形成する。小型肝細胞・星細胞との共培養では、星細胞との接触面積が多いと内皮細胞の血管形成を抑制するが、膜上に星細胞突起が少ない時に血管内皮細胞を播種し、血管形成を先に行うことで星細胞との接触のタイミングを時間的に制御可能である。
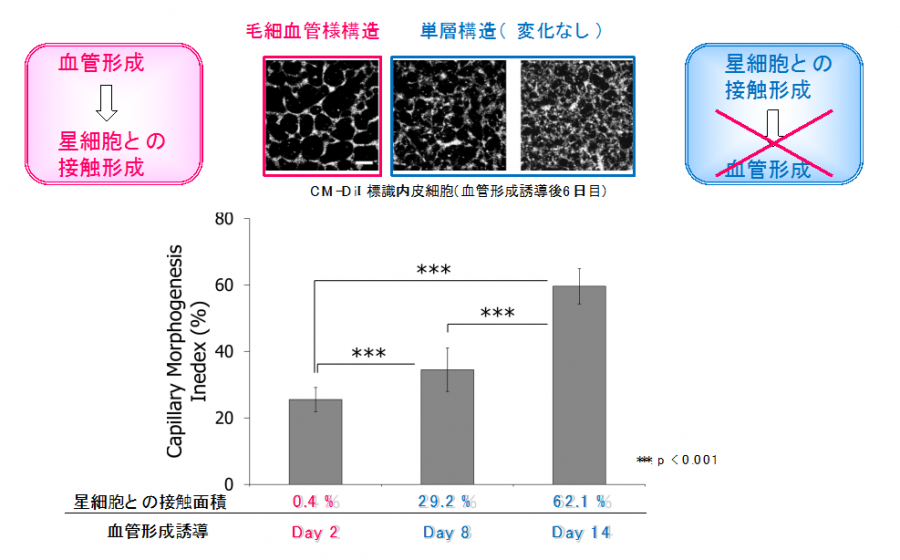
図4. 星細胞と血管内皮細胞の接触率による血管形成の効率
(Kasuya J et al, Tissue Eng A, 2012)
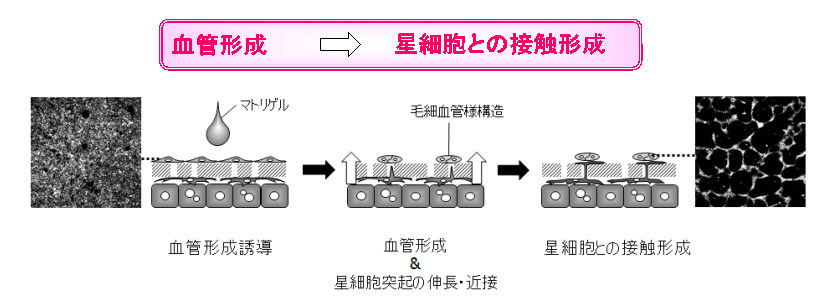
図5. 星細胞との接触のタイミングを時間的に制御することが血管形成に重要
(Kasuya J et al, Tissue Eng A, 2012)
血管形成後に星細胞との接触があると血管様構造は安定化し、長期間維持可能である。血管様構造が形成されると小型肝細胞の増殖が抑制され、大型化・成熟化する。
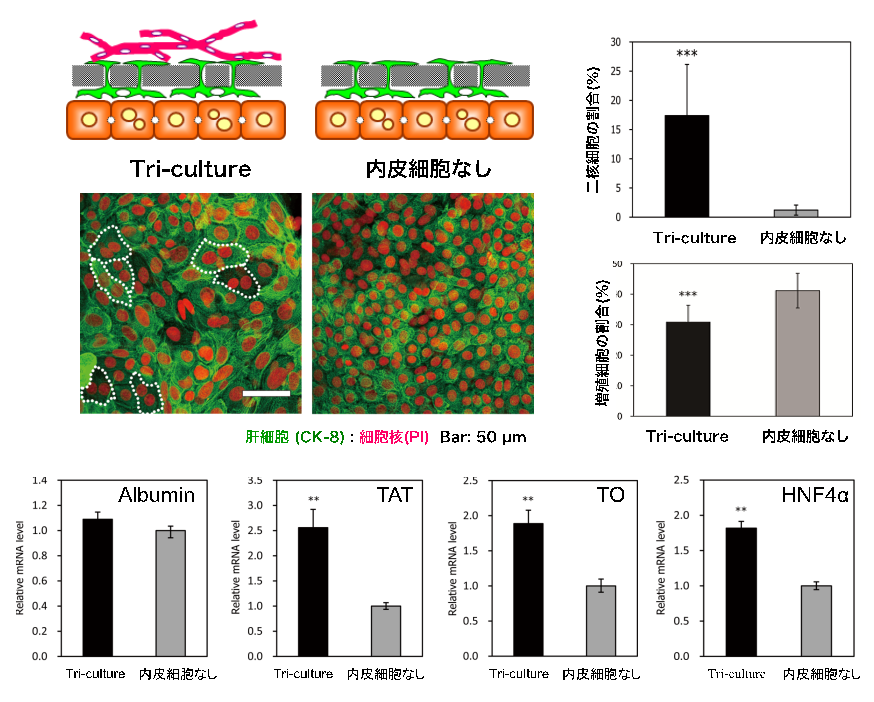
図6. 小型肝細胞と星細胞、血管内皮細胞の薄膜を介する共培養(Tri-culture)における小型肝細胞の成熟化。2核細胞の増加と増殖率の低下。肝細胞機能に関係する遺伝子発現(Realtime-PCR)。
In vitro肝組織形成においては、相互作用する細胞の接触のタイミングと空間的配置が重要である。小型肝細胞が組織化する時には、非実質細胞が徐々に小型肝細胞コロニー下に侵入し、小型肝細胞との相互作用による細胞外基質の産生・基底膜形成が小型肝細胞の成熟化・組織化に必要である。類洞形成においても同様に細胞同士の時間的・空間的配置が重要となっている。星細胞本体と血管内皮細胞が直接接すると血管内皮細胞は減少するが、星細胞本体が通らない細胞突起のみが通るサイズの孔で隔離すると血管内皮細胞はよく接着する。一方、星細胞突起量が多いと接着した血管内皮細胞の血管様構造形成は抑制されるが、培養早期の星細胞突起量が少ない時に血管が形成され、徐々に細胞突起量が増えると血管構造は維持され小型肝細胞の成熟化が誘導される。
肝組織形成において、自己組織化能力を有する細胞を用い時間的要素を加味することは組織の成熟度や維持には必須の要件である。