肝組織形成
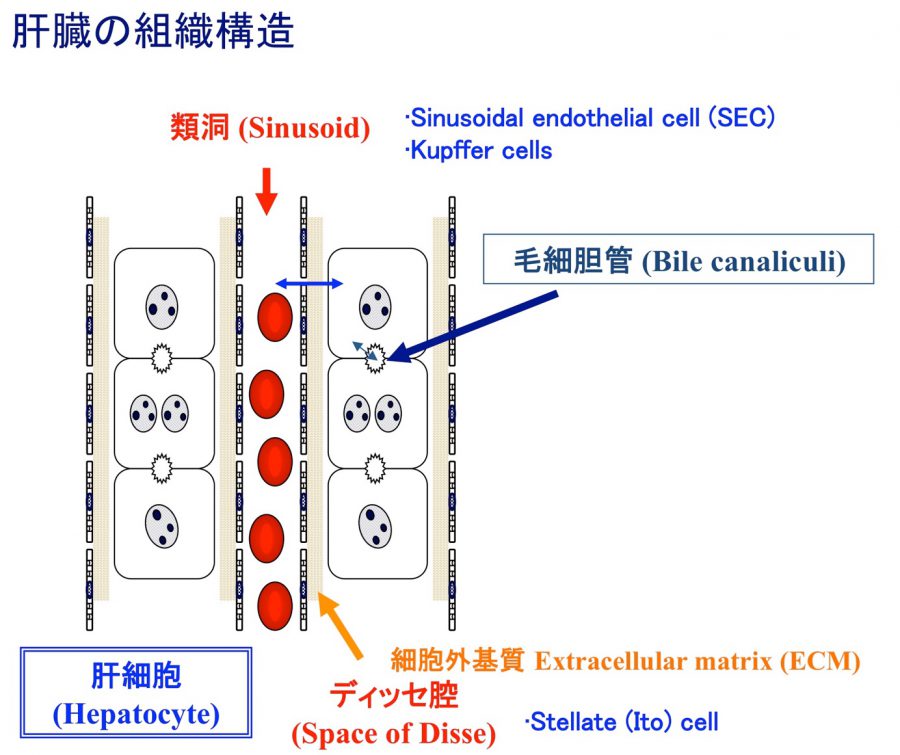
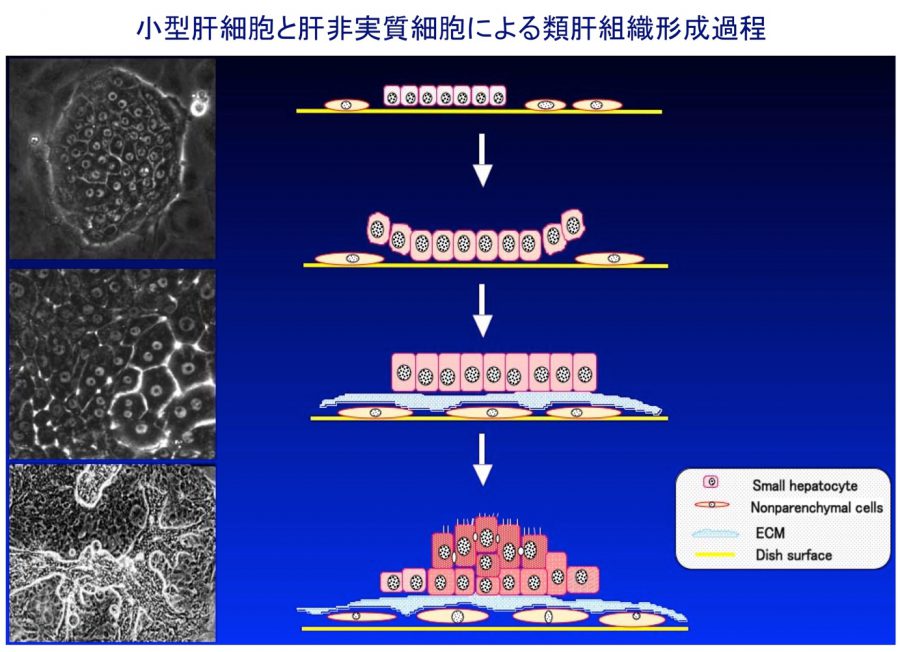
肝細胞や胆管上皮細胞は、非実質細胞や細胞外マトリックスと相互作用しながら、立体的な組織構造を構築している。我々は、小型肝細胞が血管内皮細胞や星細胞と協調して、毛細胆管構造や類洞構造を再現する系を確立した。また、胆管上皮細胞から胆管組織をin vitroで作成することにも成功している。これらの成果をもとに、肝細胞索や胆管と血管構造が一体となった肝組織(小葉構造)を再現することを目指している。
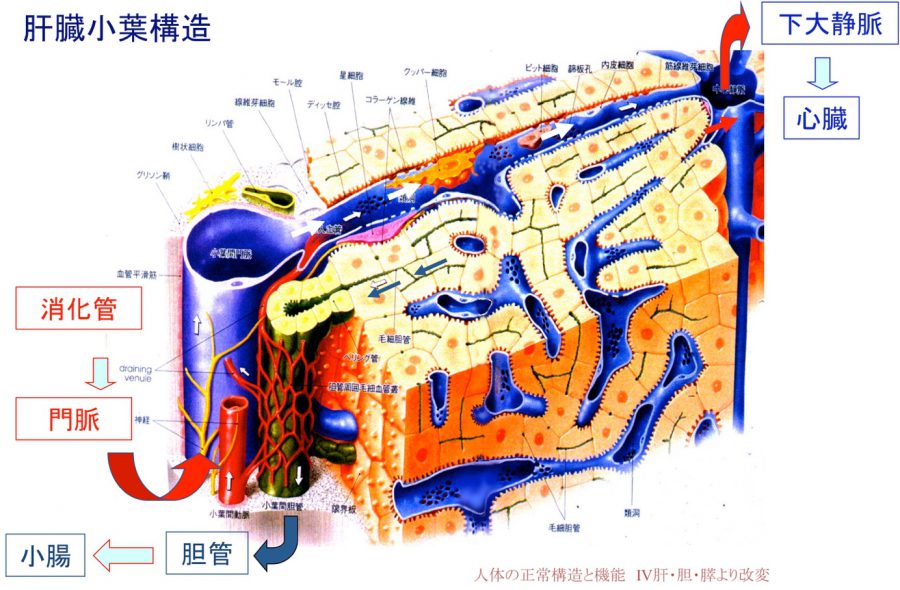
- (1)正常ラット肝小葉構造
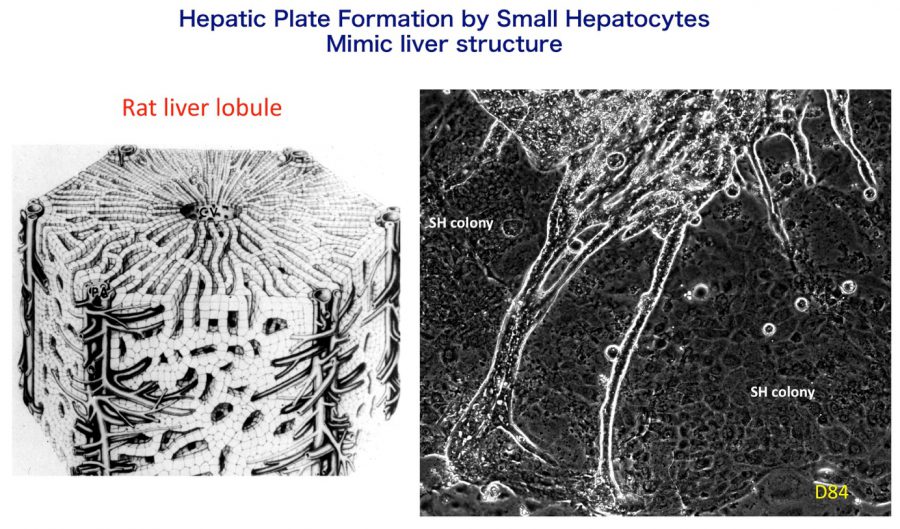
- (2)ラット小型肝細胞による類肝組織形成
- (3)スキャフォールドを利用した肝組織形成
- (3)-1 紙(Paper)
- (3)-2 コラーゲンスポンジ(Collagen Sponge)
- (3)-3 多孔性薄膜用いた肝組織形成
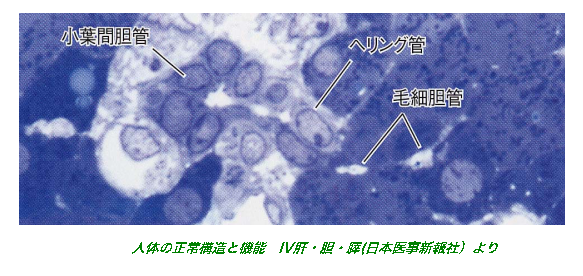
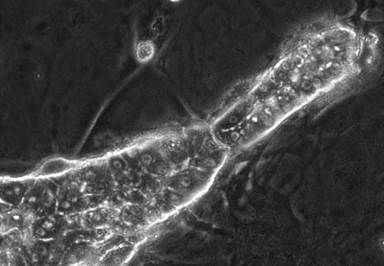
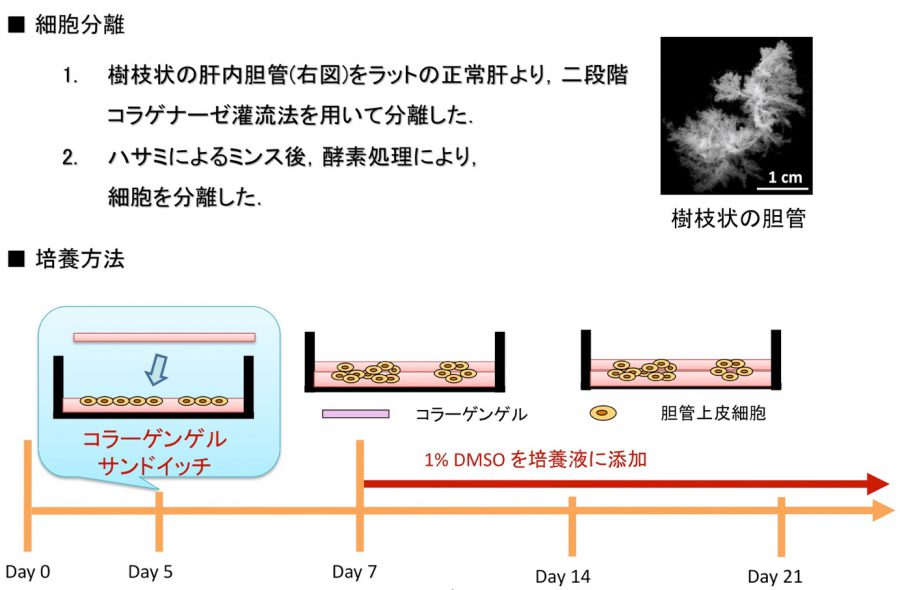
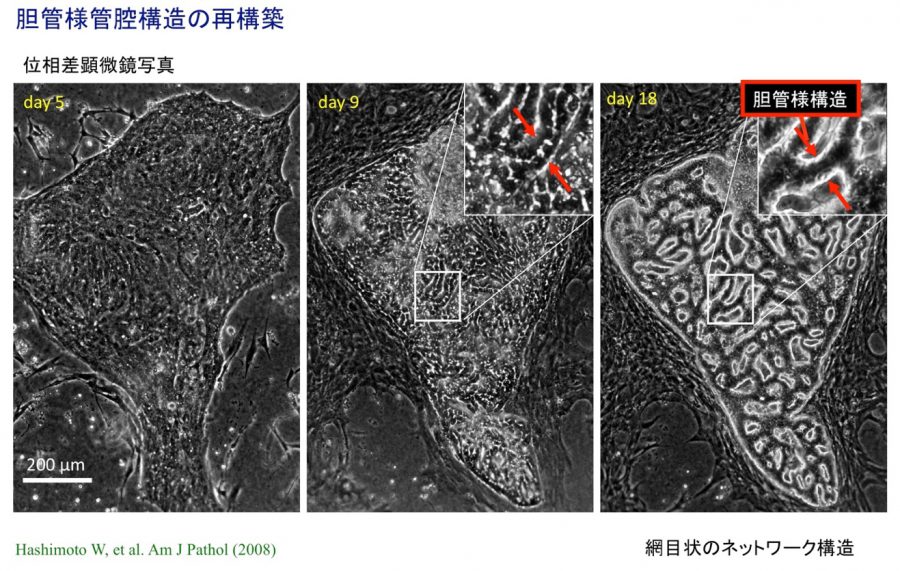
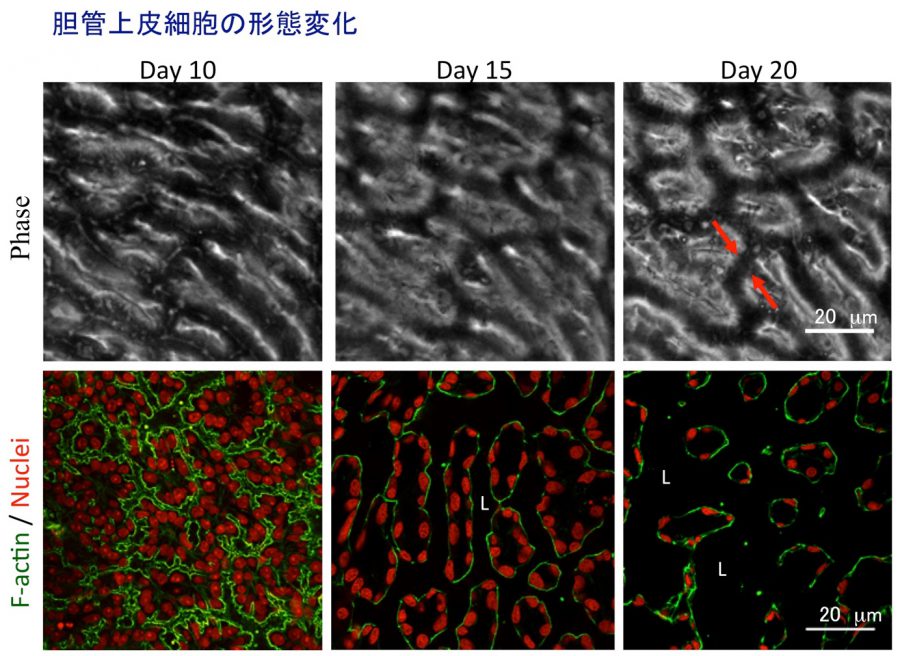
- (4)In vitro胆管形成
- Mitaka T, Sato F, Mizuguchi T, Yokono T, Mochizuki Y. Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology, 29(1), 111-125 (1999)
- Mizuguchi T, Mitaka T, Sato F, Mochizuki Y, Hirata K. Paper is compatible bed for rat hepatocytes. Artificial Organs, 24(4), 271-277 (2000)
- Harada K, Mitaka T, Miyamoto S, Sugimoto S, Ikeda S, Takeda H, Mochizuki Y, Hirata K. Rapid formation of hepatic organoid in collagen sponge by rat small hepatocytes and hepatic nonparenchymal cells. J Hepatology, 39(5), 716-723 (2003)
- Sudo R, Ikeda S, Sugimoto S, Harada K, Hirata K, Tanishita K, Mochizuki Y, Mitaka T. Bile canalicular formation in hepatic organoid reconstructed by rat small hepatocytes and nonparenchymal cells. J Cell Physiol, 199(2), 252-261 (2004)
- Sudo R, Kohara H, Mitaka T, Ikeda M, Tanishita K. Coordinated movement of bile canalicular networks reconstructed by rat small hepatocytes. Annals of Biomedical Engineering (Ann Biomed Eng), 33(5), 696-708 (2005)
- Sugimoto S, Harada K, Shiotani T, Ikeda S, Katsura N, Ikai I, Mizuguchi T, Hirata K, Yamaoka Y, Mitaka T. Hepatic organoid formation in collagen sponge of cells isolated from human liver tissues. Tissue Engineering, 11(3-4), 626-633 (2005)
- Sudo R, Mitaka T, Ikeda M, Tanishita K. Reconstruction of 3D stacked-up structures by rat small hepatocytes on microporous membranes. FASEB J, 19(12), 1695-1697 (2005)
- Sudo R, Mitaka T, Ikeda M, Tanishita K. Maintenance of cell morphology and function by vertical cell-cell adhesion in three-dimensional stacked-up culture of rat hepatocyte. Journal of Biomechanical Science and Engineering 3 (2): 235–248 (2008)
- Sudo R, Takahashi N, Mitaka T, Ikeda M, Tanishita K. The effect of micropatterned pores on the formation and movement of small hepatocyte colonies. Journal of Biomechanical Science and Engineering 3 (2): 249–262 (2008)
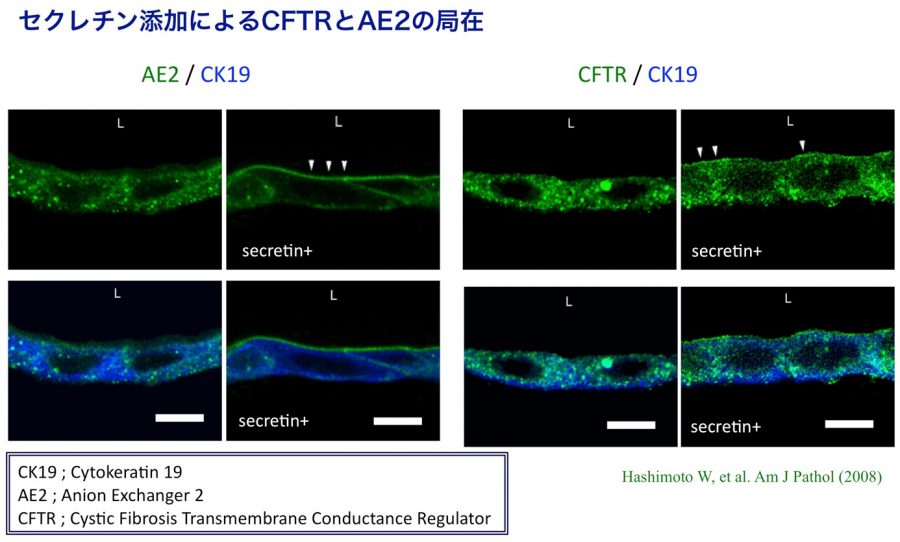
- Hashimoto W, Sudo R, Fukasawa K, Ikeda M, Mitaka T, Tanishita K. Ductular network formation by rat biliary epithelial cells in the dynamical culture with collagen gel and dimethylsulfoxide stimulation. Am J Pathol, 173(2), 494-506 (2008)
- Kasuya J, Sudo R, Mitaka T, Ikeda M, Tanishita K. Hepatic stellate cell-mediated 3D tri-culture model of hepatocytes and endothelial cells. Tissue Eng A, 17(3-4): 361-370 (2011)
- Kasuya J, Sudo R, Mitaka T, Ikeda M, Tanishita K. Spatio-temporal Control of Hepatic Stellate Cell-Endothelial Cell Interactions for Reconstruction of Liver Sinusoids in vitro. Tissue Engineer A, 18(9-10): 1045-1056 (2012)
- Kasuya J, Sudo R, Tamogami R, Masuda G, Mitaka T, Ikeda M, Tanishita K. Reconstruction of 3D stacked-up hepatocyte tissues by degradation of microporous poly (D, L-lactide-co-glycolide acids) membranes. Biomaterials, 33(9): 2693-2700 (2012)
- Kasuya J, Sudo R, Masuda G, Mitaka T, Ikeda M, Tanishita K. Reconstruction of hepatic stellate cell-incorporated liver sinusoidal structures in small hepatocyte tri-culture using microporous membranes. J Tissue Eng Regen Med (TERMS), 9(3): 247-256 (2015)